Category: Tế bào gốc Thế giới
-
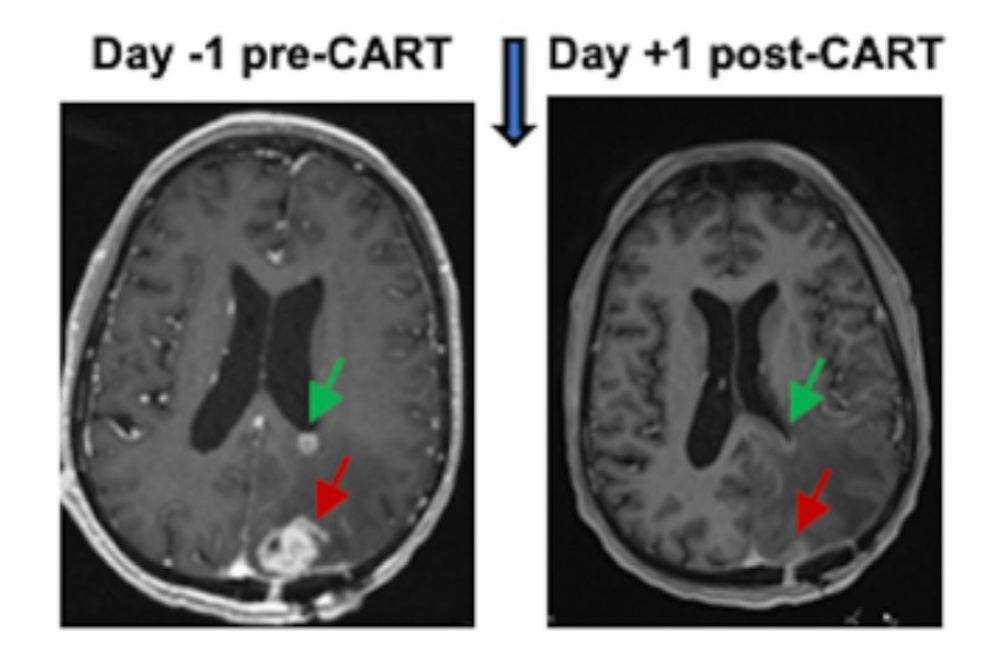
Liệu pháp CAR T-Cell mang đến hy vọng mới cho ung thư não
Với thời gian sống trung bình chỉ từ 15 đến 18 tháng, chẩn đoán u nguyên bào thần kinh đệm (glioblastoma), một dạng ung thư não hiếm và xâm lấn, thường được coi như một bản án tử. Điều này có thể thay đổi nhờ liệu pháp CAR T-cell. Phương pháp này đã tạo ra…
-
Buồng trứng nhân tạo đang trên đường phát triển
Theo Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (Mĩ), 13,4% phụ nữ từ 15 đến 49 tuổi bị suy giảm khả năng sinh sản do các nguyên nhân khác nhau như hội chứng buồng trứng đa nang và lạc nội mạc tử cung do tác động của một số loại thuốc. Trong nhiều…
-
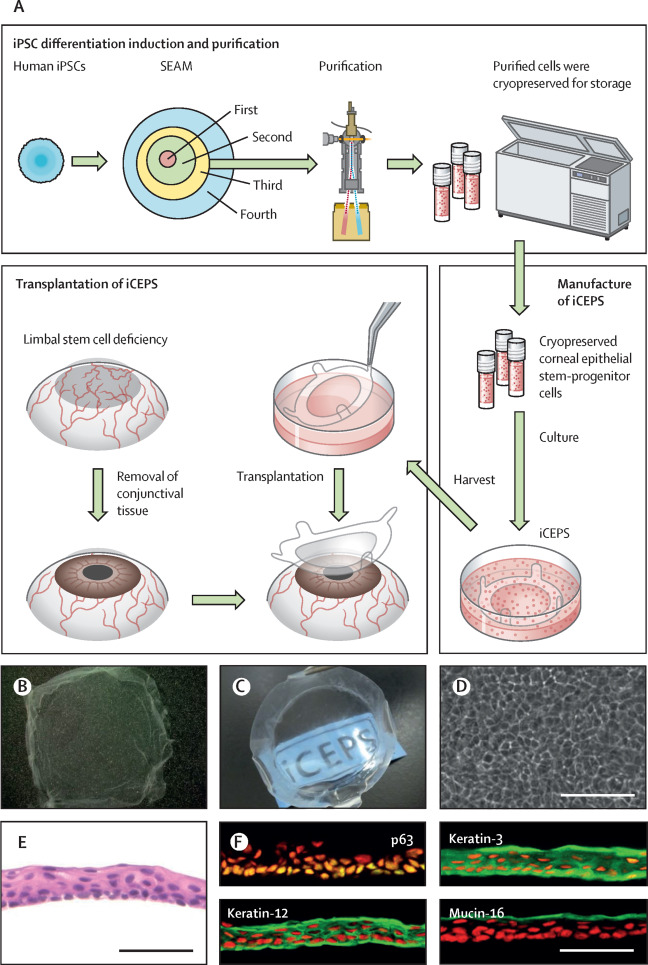
Liệu pháp tế bào gốc đột phá phục hồi thị lực
Các lớp tế bào mỏng manh bao phủ giác mạc, lớp ngoài cùng hình vòm của mắt, có thể dễ dàng bị tổn thương do bỏng, nhiễm trùng, bệnh viêm mắt và thậm chí là tác dụng phụ của một số loại thuốc. Đây là tình trạng được gọi là thiếu tế bào gốc biểu…
-
Tế bào tim được biệt hóa từ tế bào gốc an toàn ở khỉ, có thể điều trị bệnh tim bẩm sinh
Các tế bào cơ tim được biệt hóa từ tế bào gốc cho thấy tiềm năng ở khỉ có một vấn đề tim thường do dị tật tim đôi khi xuất hiện từ khi sinh ra ở con người, theo nghiên cứu mới từ Đại học Wisconsin-Madison và Mayo Clinic. Bệnh tim, nguyên nhân gây…
-
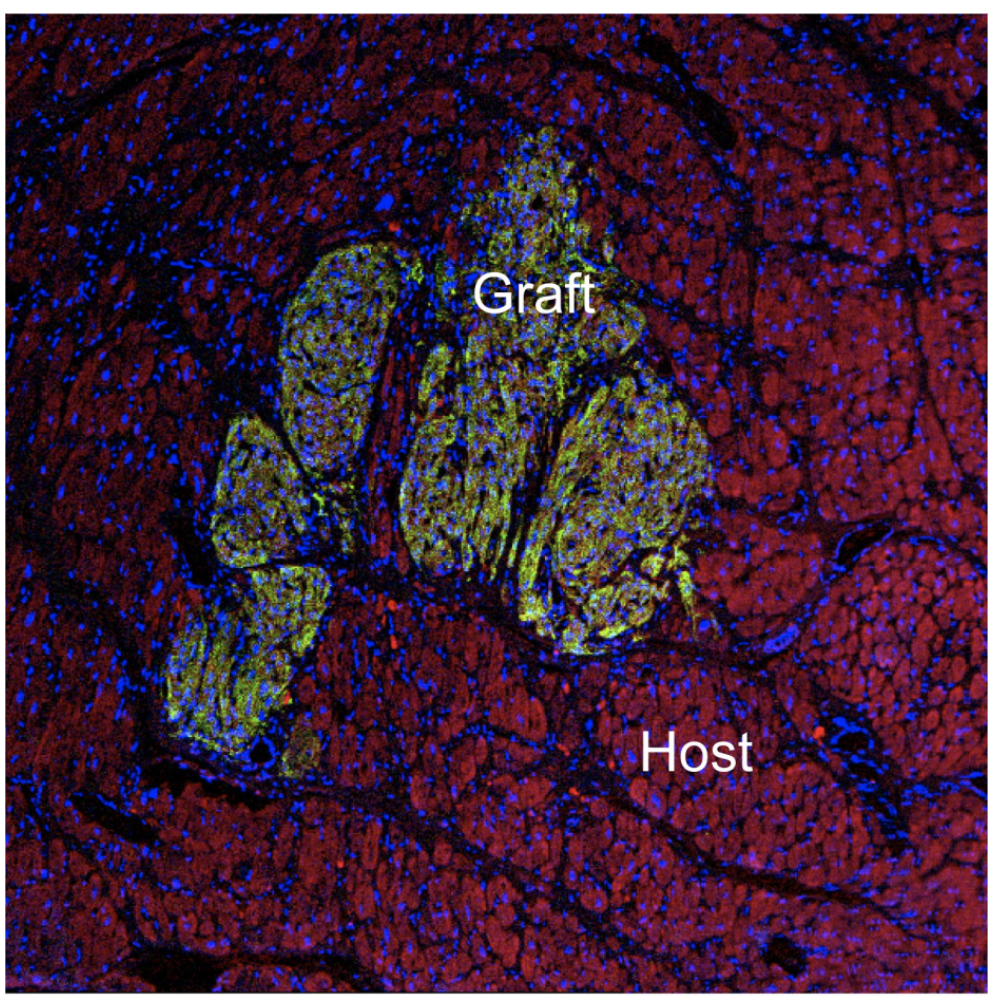
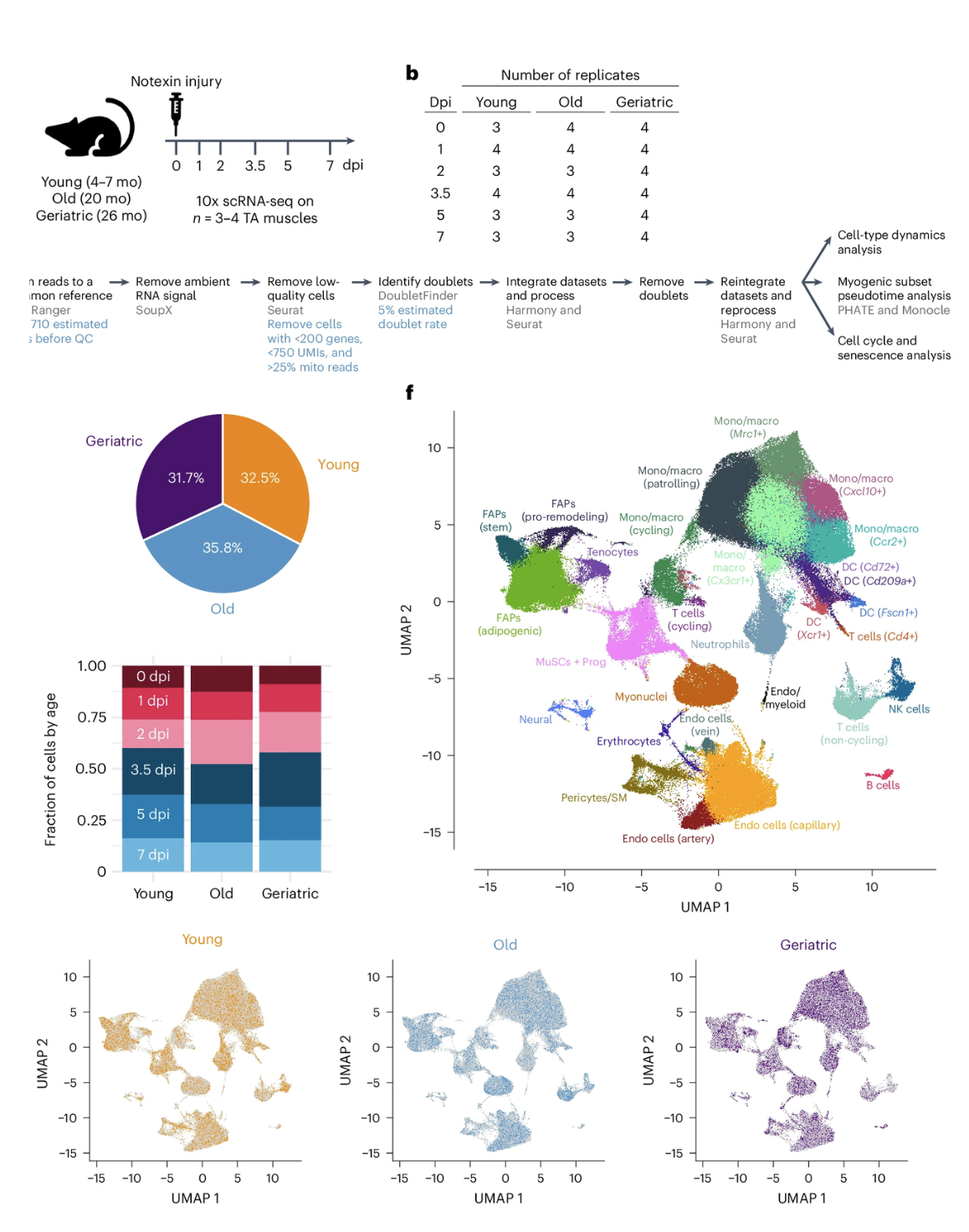
Nghiên cứu trên chuột nắm bắt quá trình lão hóa ở mức độ tế bào
Khi cơ bắp già đi, các tế bào của chúng mất khả năng tái tạo và chữa lành sau khi bị thương. Hiện nay, các nhà nghiên cứu tại Đại học Cornell đã tạo ra bức chân dung toàn diện nhất cho đến nay về cách thay đổi đó, ở chuột, diễn ra theo thời…
-
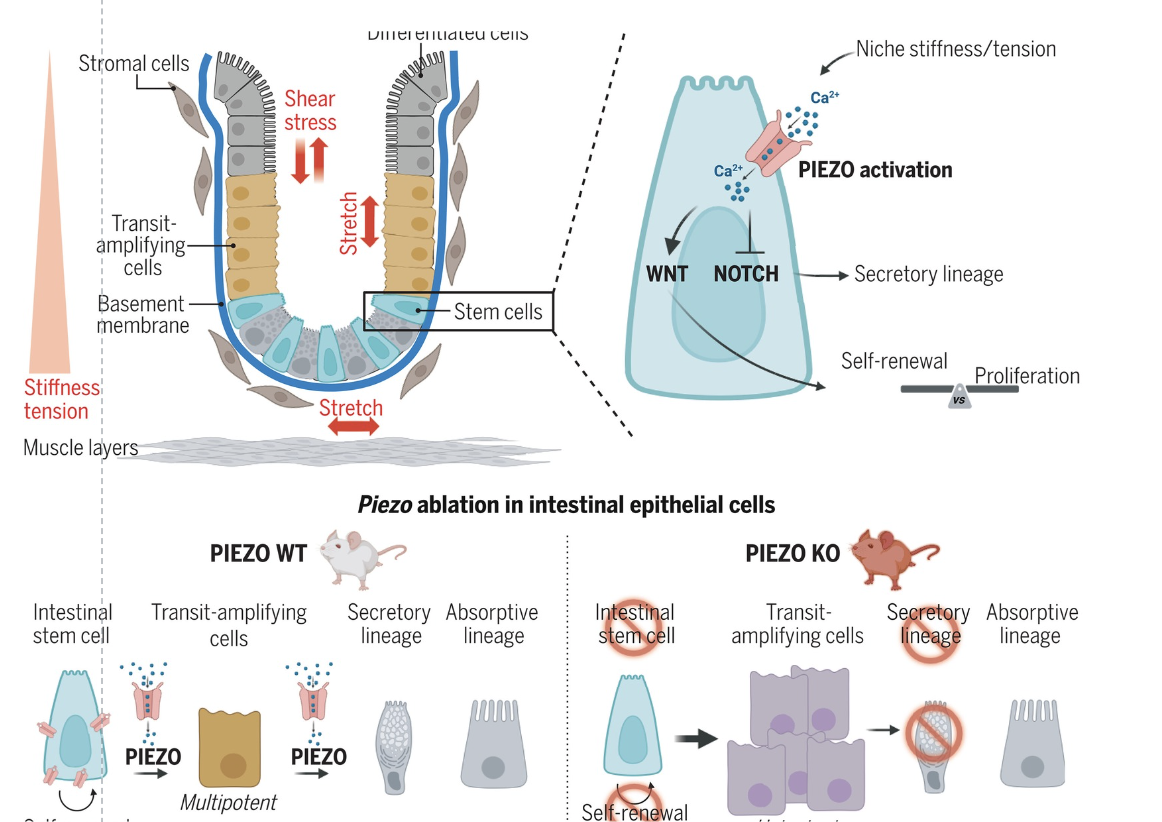
Mối quan hệ quan trọng giữa tế bào gốc và tín hiệu cơ học được tiết lộ
Một nghiên cứu mới từ Bệnh viện Sick Children (SickKids) và Viện Curie tiết lộ cách tế bào gốc cảm nhận và phản ứng với môi trường của chúng, có ý nghĩa đối với bệnh viêm ruột và ung thư đại trực tràng. Tế bào gốc liên tục thích nghi với môi trường của chúng…
-
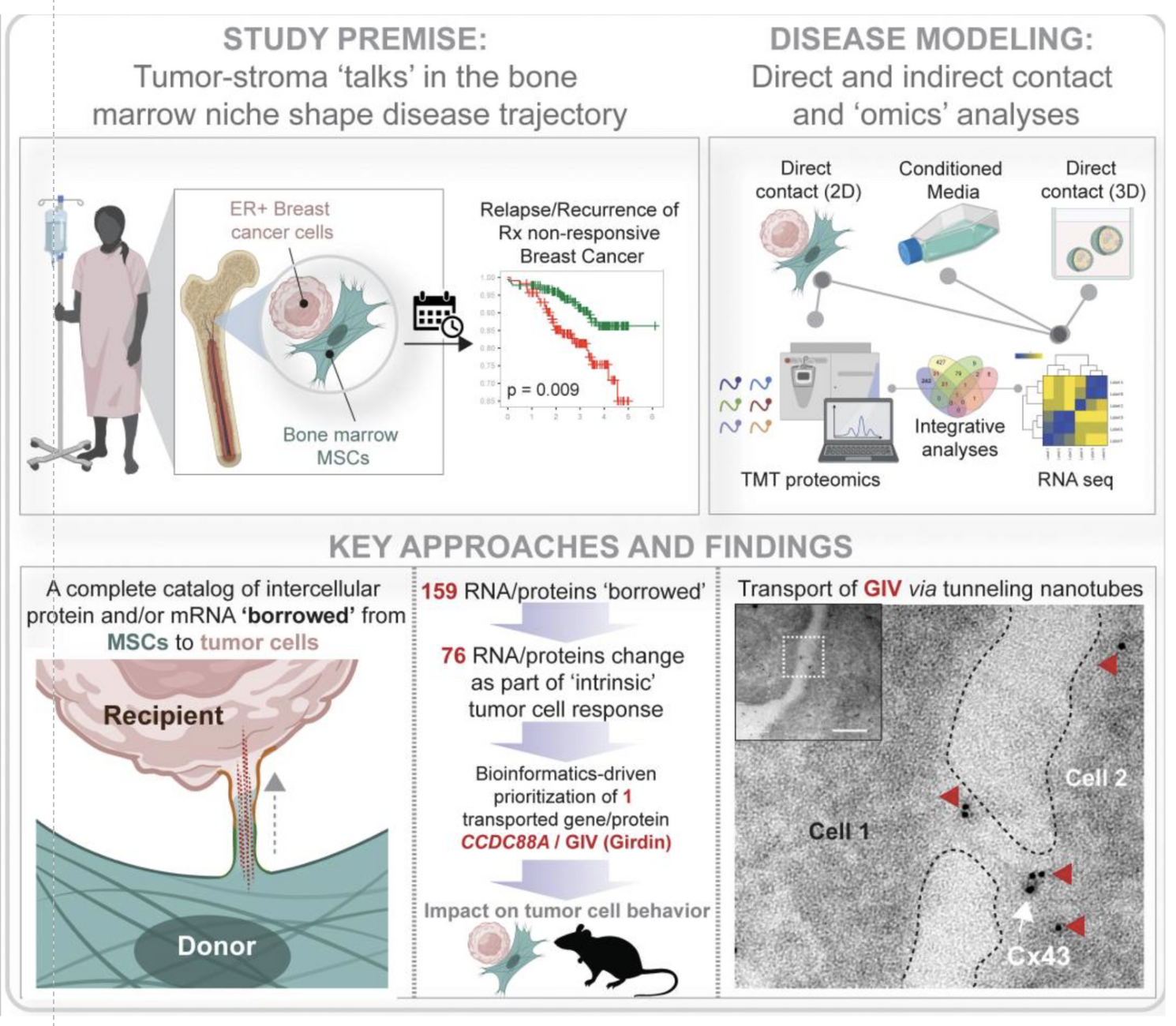
Cách tế bào ung thư vú sống sót trong tủy xương sau khi thuyên giảm
Một nghiên cứu từ các nhà nghiên cứu tại Đại học Michigan và Đại học California San Diego đã làm sáng tỏ một khía cạnh trước đây ít được hiểu rõ về tái phát ung thư vú: cách các tế bào ung thư sống sót trong tủy xương mặc dù có liệu pháp nhắm mục…
-
Những thay đổi trong quá trình sản xuất tế bào máu suốt đời có thể ảnh hưởng đến kết quả bệnh bạch cầu
Các nhà nghiên cứu tại Trường Y Đại học California, San Diego và các đồng nghiệp đã phát triển bản đồ toàn diện đầu tiên về những thay đổi mạnh mẽ diễn ra trong hệ thống máu suốt đời người. Nhóm nghiên cứu đã định lượng biểu hiện gen của hơn 58.000 tế bào gốc…
-
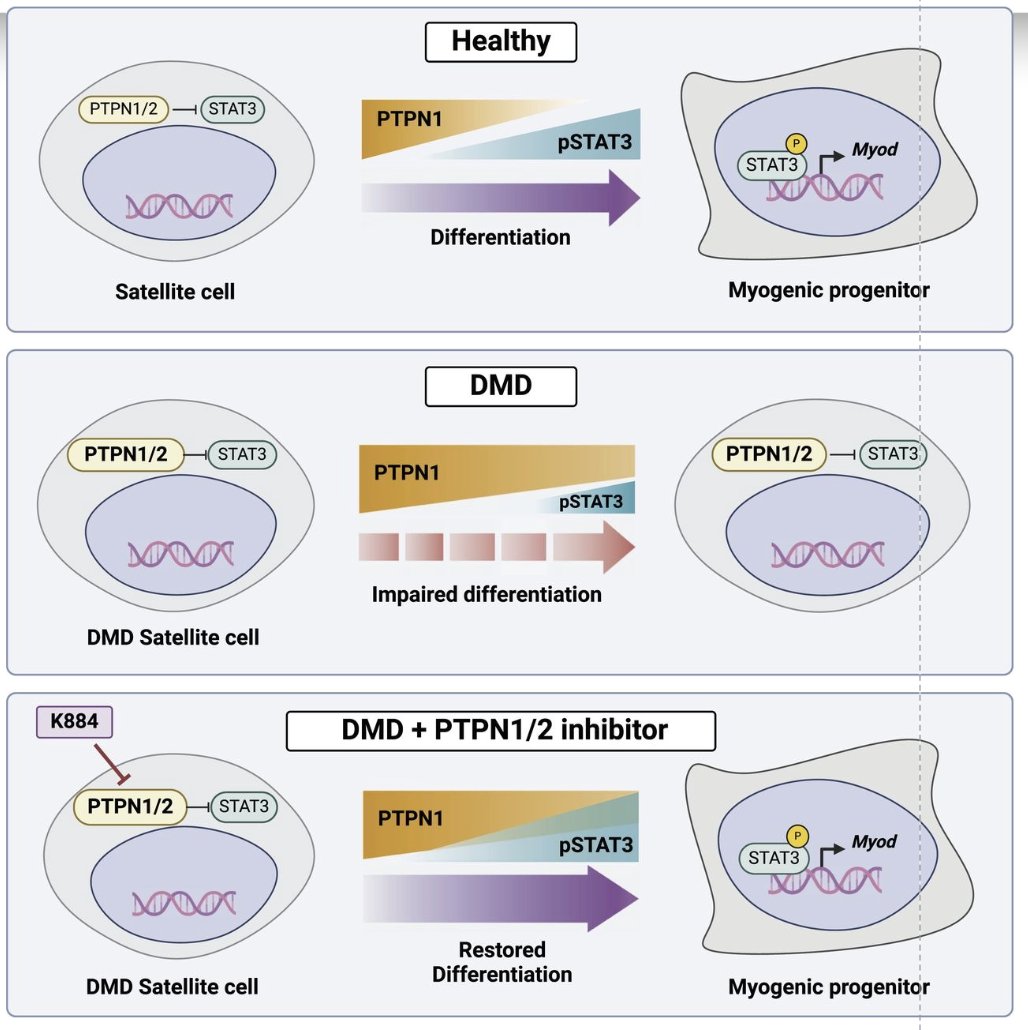
Thuốc mới cho thấy triển vọng chống lại bệnh loạn dưỡng cơ Duchenne
Một loại thuốc mới có triển vọng trong việc điều trị bệnh loạn dưỡng cơ Duchenne (DMD), một rối loạn di truyền hiếm gặp gây thoái hóa cơ nghiêm trọng. Các nhà nghiên cứu tại Đại học McGill đã phát hiện ra rằng một hợp chất thử nghiệm có tên K884 có thể tăng cường…
-
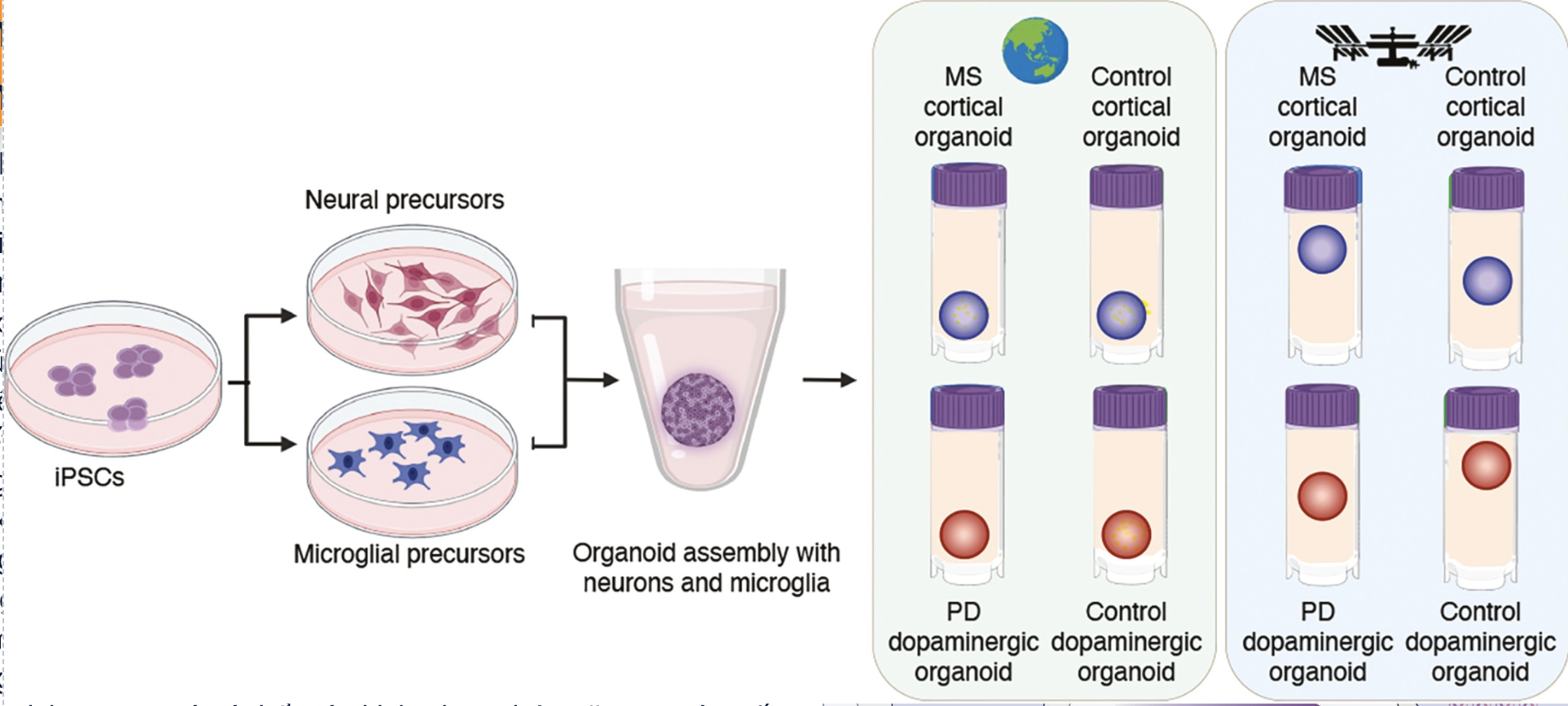
Tế bào não vẫn khỏe mạnh sau một tháng trên Trạm Vũ trụ Quốc tế, nhưng trưởng thành nhanh hơn so với tế bào não trên Trái Đất
Trọng lực vi mô được biết đến là thay đổi cơ bắp, xương, hệ miễn dịch và nhận thức, nhưng ít người biết về tác động cụ thể của nó lên não. Để khám phá cách tế bào não phản ứng với trọng lực vi mô, các nhà khoa học nghiên cứu Scripps, hợp tác…