Liệu pháp gen này điều trị bệnh di truyền hiếm gặp AADC bằng cách đưa một gen chức năng vào não. Cho đến gần đây, bệnh di truyền hiếm gặp thiếu hụt aromatic L-amino acid decarboxylase (AADC) vẫn chưa có cách chữa trị. Bệnh khởi phát trong những tháng đầu sau sinh, ảnh hưởng đến thể chất, tinh thần và hành vi, và các phương pháp điều trị trước đây chủ yếu chỉ tập trung vào kiểm soát triệu chứng. Tuy nhiên, mọi thứ đang thay đổi với sự ra đời của các liệu pháp gen mới nhắm vào nguyên nhân gốc rễ của bệnh.
Vào ngày 13 tháng 11 năm 2024, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt một liệu pháp gen để điều trị chứng thiếu hụt AADC ở cả trẻ em và người lớn. Loại thuốc này, do PTC Therapeutics phát triển, là liệu pháp gen đầu tiên sử dụng virus adeno-associated (AAV) được đưa trực tiếp vào não được FDA chấp thuận.
Liệu pháp gen có tên Kebilidi (eladocagene exuparvovec-tneq) là liệu pháp dựa trên AAV type 2, chứa gen dopa decarboxylase (DDC) của người, gen này mã hóa cho việc sản xuất enzyme AADC. AADC đóng vai trò quan trọng trong bước cuối cùng để tạo ra các chất dẫn truyền thần kinh dopamine và serotonin. Nồng độ thấp của các chất dẫn truyền thần kinh này dẫn đến sự suy giảm khả năng giao tiếp giữa các tế bào thần kinh.
“Kết quả an toàn mà họ ghi nhận được thật tuyệt vời. Đó là một sự cải thiện đáng kể về chức năng vận động và chất lượng cuộc sống của bệnh nhân.”
– Christina Pacak, Đại học Minnesota .
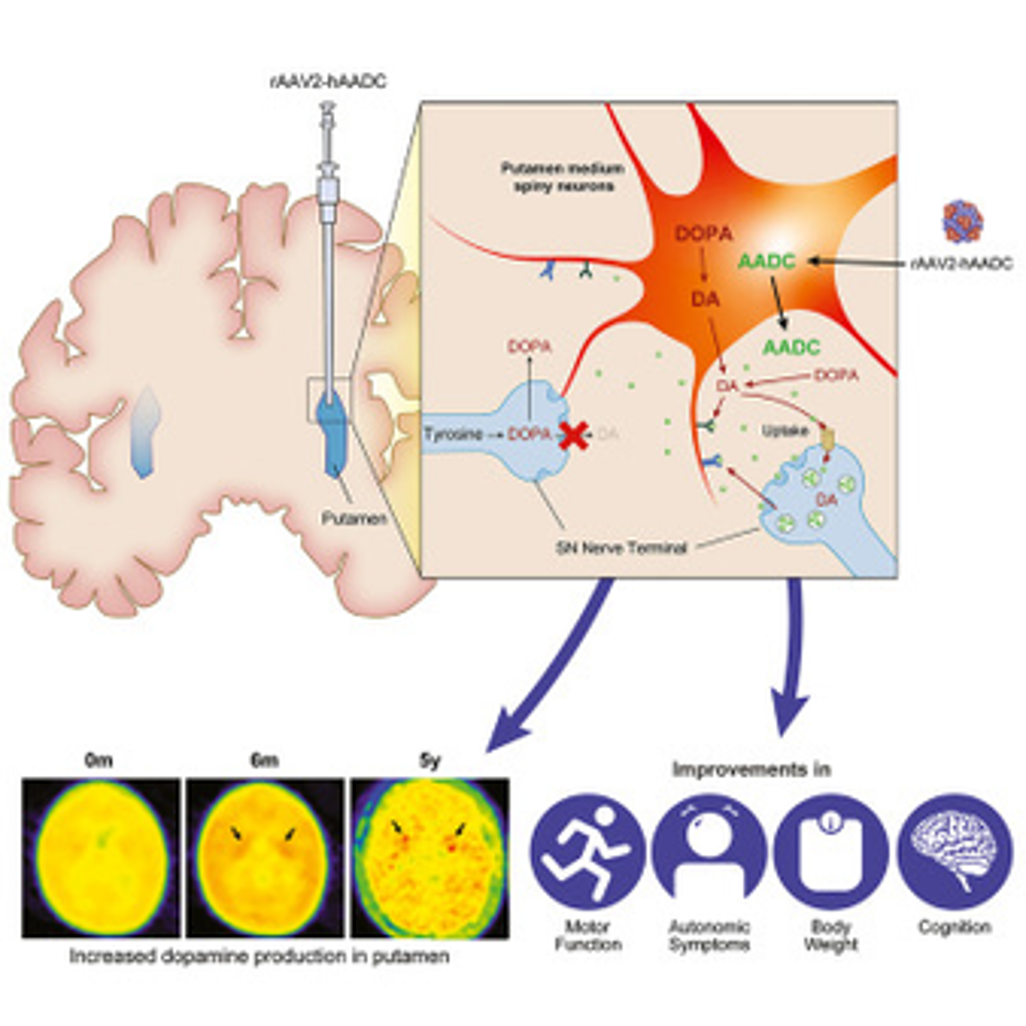
Việc đưa Kebilidi vào cơ thể đòi hỏi các bác sĩ phẫu thuật thần kinh phải tiêm trực tiếp vào vùng putamen – một khu vực của não tham gia vào việc điều chỉnh vận động – bằng một thủ thuật xâm lấn tối thiểu sử dụng hệ thống định vị 3D để hướng dẫn. Việc đưa thuốc AAV vào não rất khó khăn do hàng rào máu não, một lớp màng giúp bảo vệ não khỏi vi khuẩn, virus và các chất có hại khác.
Guangping Gao, một nhà nghiên cứu liệu pháp gen tại UMass Chan Medical School, cho biết: “Điều này có lợi trong điều kiện bình thường, nhưng lại là rào cản đối với các phương tiện vận chuyển gen.” Để đưa liệu pháp gen vào não, các bác sĩ phải tiêm trực tiếp hoặc sử dụng một serotype AAV như AAV9, loại có thể vượt qua hàng rào máu não nhờ cấu trúc vỏ ngoài và tương tác với thụ thể.
Christina Pacak, nhà sinh học phân tử tại Đại học Minnesota, cho biết việc đưa thuốc bằng phẫu thuật có thể giúp tăng tính an toàn của liệu pháp gen. “Nó giúp duy trì liều lượng tương đối thấp và không cần phải áp dụng toàn thân.” Tuy nhiên, điều này cũng có nghĩa là liệu pháp này chỉ có thể được thực hiện tại các trung tâm y tế có kỹ thuật phẫu thuật thần kinh và thiết bị chẩn đoán hình ảnh hiện đại.
“Đây không đơn giản chỉ là truyền tĩnh mạch, một thủ thuật đơn giản hơn nhiều. Luôn có những câu hỏi về khả năng tiếp cận các liệu pháp này vì nhiều lý do khác nhau,” Pacak nói.
Hành trình phê duyệt của Kebilidi
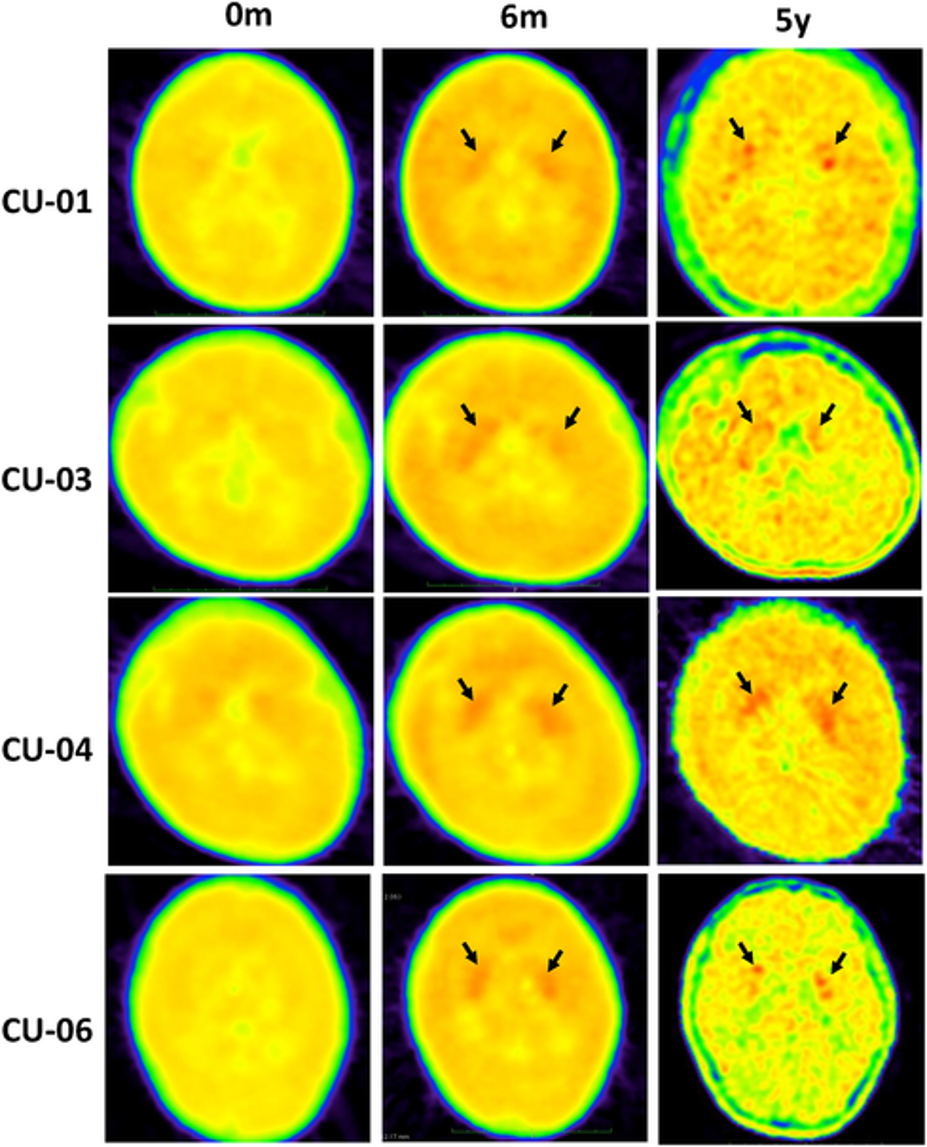
Trong khi Kebilidi là phiên bản đầu tiên được FDA chấp thuận tại Mỹ, eladocagene exuparvovec đã được phê duyệt tại một số quốc gia khác dưới tên thương mại Upstaza (cũng do PTC Therapeutics phát triển). Năm 2022, Anh và EU đã phê duyệt Upstaza sau 3 thử nghiệm lâm sàng liên tiếp trên 26 bệnh nhân, trong đó ghi nhận bệnh nhân cải thiện nhanh chóng trong vòng 12 tháng sau điều trị. Một số bệnh nhân thậm chí có thể đi lại được sau 3 năm (1). FDA phê duyệt Kebilidi dựa trên kết quả an toàn và hiệu quả tích cực từ một thử nghiệm lâm sàng toàn cầu, với các nghiên cứu theo dõi dài hạn vẫn đang tiếp tục. “Tôi cho rằng đây là một thành công thực sự,” Pacak nhận định.
Tiềm năng cho các liệu pháp gen thần kinh trong tương lai
Gao cũng chỉ ra rằng hệ thần kinh trung ương (CNS) là mục tiêu lý tưởng cho các liệu pháp gen như Kebilidi, vì chúng chỉ cần một lần tiêm duy nhất. “CNS có lẽ là mục tiêu lý tưởng cho các liệu pháp gen nhờ vào đặc điểm của các loại tế bào trong não,” ông giải thích. Hầu hết tế bào thần kinh là tế bào đã biệt hóa hoàn toàn, nghĩa là chúng không thể phân chia, do đó chỉ cần một liều duy nhất để đạt được biểu hiện gen lâu dài.
“Thành công và kinh nghiệm từ quá trình chuyển giao và thương mại hóa liệu pháp này sẽ giúp chúng tôi phát triển thêm nhiều sản phẩm trị liệu gen CNS khác,” Gao nói. Là liệu pháp gen AAV đầu tiên được đưa vào não được phê duyệt tại Mỹ, Kebilidi sẽ mở đường cho các nỗ lực điều trị nhiều bệnh lý não bộ khác trong tương lai.
Nghiên cứu cho thấy 3 bệnh nhân có thể đi lại được sau 3 năm điều trị.