Theo hai báo cáo trình bày tại Hội nghị về Retrovirus và Nhiễm trùng Cơ hội (CROI 2025) tuần này ở San Francisco, thêm hai bệnh nhân dường như đã loại bỏ được HIV sau khi cấy ghép tế bào gốc để điều trị ung thư. Nếu tình trạng thuyên giảm được duy trì, họ sẽ trở thành ca thứ 9 và 10 được chữa khỏi HIV chức năng nhờ phương pháp này.

tại hội nghị Croi 2025. Ảnh của Roger Pebody.
Bệnh nhân đầu tiên, biệt danh “bệnh nhân Chicago”, từng tái phát virus sau lần ngừng điều trị ARV đầu tiên nhưng vẫn duy trì thuyên giảm sau 10 tháng ngừng thuốc lần hai. Bệnh nhân thứ hai – “bệnh nhân Oslo” – được ghép tế bào gốc từ anh em ruột và dùng thuốc ức chế miễn dịch ruxolitinib để điều trị bệnh ghép chống chủ (GVHD) nặng; anh này vẫn ổn định sau 2 năm ngừng ARV.
Dù cấy ghép tế bào gốc quá rủi ro với người không mắc ung thư giai đoạn cuối, mỗi ca mới đều cung cấp manh mối giúp giới khoa học phát triển phương pháp chữa khỏi HIV chức năng phổ biến hơn.
“Từng trường hợp đều quan trọng để tích lũy kiến thức về cơ chế chữa khỏi”, TS. Marius Trøseid từ Bệnh viện Đại học Oslo phát biểu tại họp báo. “Giờ cần so sánh các ca này để tìm điểm chung… nhằm ứng dụng vào nghiên cứu tương lai.”
8 trường hợp chữa khỏi trước đó
Liệu pháp kháng retrovirus (ART) có thể kiểm soát HIV vô thời hạn, nhưng virus này tích hợp bộ gene vào tế bào chủ, tạo thành kho dự trữ dai dẳng gần như không thể tiêu diệt.
Người đầu tiên được chữa khỏi HIV – Timothy Ray Brown, “bệnh nhân Berlin” – trải qua hai lần ghép tế bào gốc điều trị bệnh bạch cầu dòng tủy cấp (AML) từ người hiến mang hai bản đột biến CCR5-delta-32 – gene vô hiệu hóa thụ thể mà đa số chủng HIV dùng để xâm nhập tế bào. Trước ghép tạng, ông được hóa-xạ trị mạnh để tiêu diệt tế bào miễn dịch ác tính. Sau đó, ông suýt chết vì GVHD – khi tế bào miễn dịch hiến tặng tấn công cơ thể nhận. Như báo cáo năm 2008, dù ngừng ART nhưng tải lượng virus không tăng lại. Suốt nhiều năm, xét nghiệm máu, ruột và mô khác đều không phát hiện HIV nguyên vẹn. Khi qua đời tháng 9/2020, Brown sống không HIV hơn 13 năm.

Tim, das
Wunder
Er ist eine Weltsensation,,,The Berlin
Patient”: Timothy Ray Brown gilt
als der erste Mensch, der vom AIDS-
ERREGER HIV geheilt wurde. Dabei
verdankt er seine Rettung einem
tragischen Zufall: Ihn befiel eine noch
Timothy Ray Brown – bệnh nhân đầu tiên được chữa khỏi HIV.
Bốn người khác – Adam Castillejo (“bệnh nhân London”), Marc Franke (“bệnh nhân Düsseldorf”), Paul Edmonds (“bệnh nhân City of Hope”) và một phụ nữ Marseille (“bệnh nhân Pháp”) – cũng khỏi bệnh nhờ ghép tế bào gốc từ người hiến đột biến kép CCR5-delta-32. Tất cả đều ngừng ARV mà không tái phát.

(“bệnh nhân London”)

(“bệnh nhân Düsseldorf”)

(“bệnh nhân City of Hope”)
Chân dung những bệnh nhân khỏi bệnh nhờ ghép tế bào gốc từ người hiến đột biến kép CCR5-delta-32
Ban đầu, giới chuyên gia cho rằng Brown khỏi bệnh nhờ đột biến kép. Nhưng năm 2022, các nhà nghiên cứu mô tả “bệnh nhân New York” – phụ nữ mắc bạch cầu được ghép kết hợp tế bào máu cuống rốn đột biến CCR5-delta-32 và tế bào gốc trưởng thành từ người thân không đột biến. Năm sau, Romuald (“bệnh nhân Geneva”) dường như khỏi HIV sau ghép tế bào gốc “hoang dã” không mang đột biến. Mùa hè 2024, giới khoa học công bố “bệnh nhân Berlin mới” – nam giới mang một bản đột biến, duy trì thuyên giảm dài hạn sau ghép từ người hiến cũng có một bản sao.
TS. Paul Rubinstein từ Trung tâm Y tế Đại học Illinois tại Chicago trình bày trường hợp nam 67 tuổi, nhiễm HIV 14 năm trước khi chẩn đoán AML. Ông được điều trị giảm cường độ kết hợp ghép tế bào gốc từ người hiến không liên quan mang đột biến kép CCR5-delta-32. Một năm sau, tải lượng virus, RNA/DNA HIV trong tế bào máu ngoại vi và đáp ứng tế bào T CD4/CD8 đặc hiệu HIV không phát hiện được, kháng thể HIV ở mức thấp nên ông ngừng ART sau 15 tháng ghép.
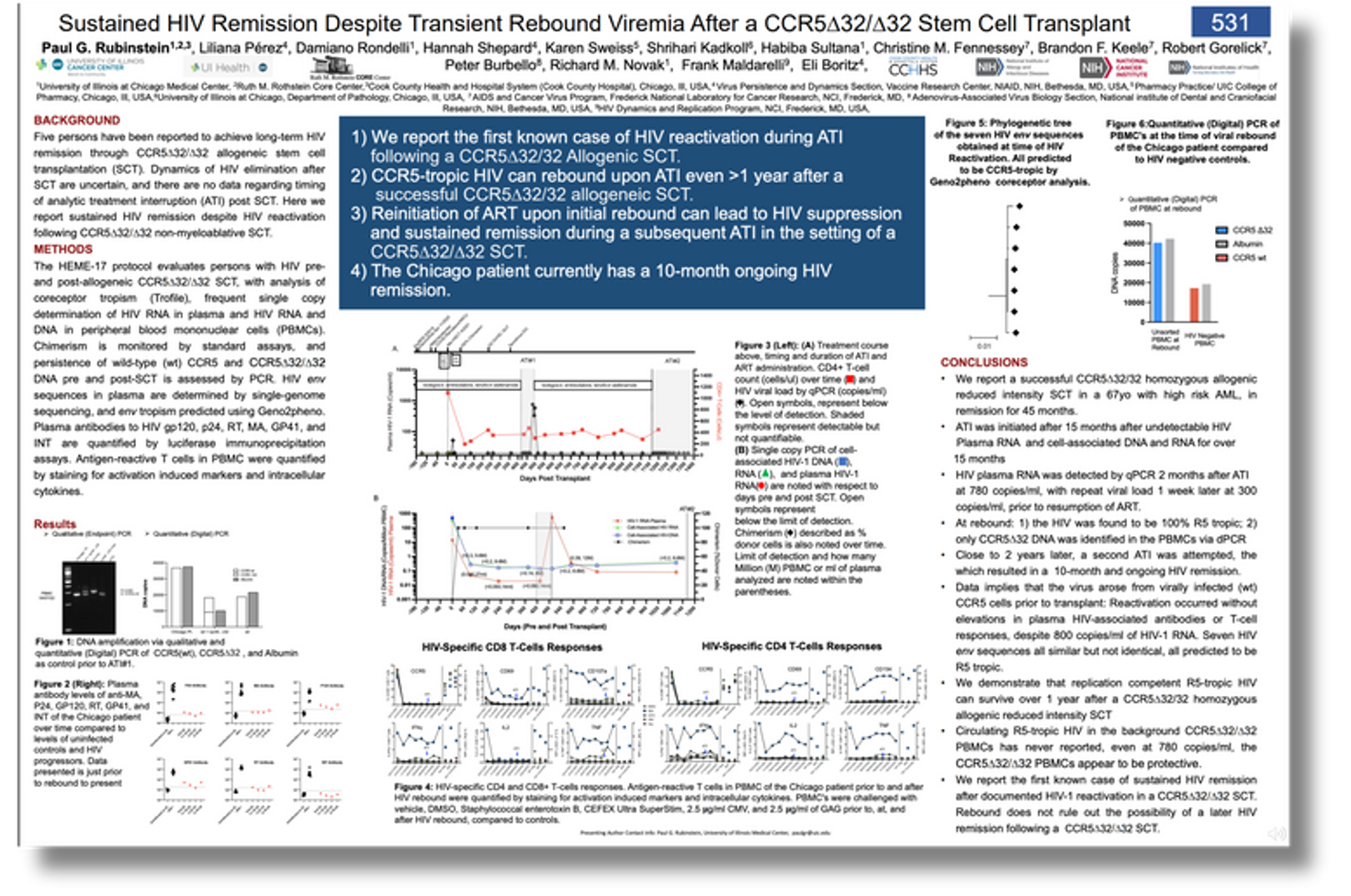
Bệnh nhân Chicago của mình
Khoảng hai tháng sau, tải lượng virus tăng vọt lên gần 800 bản sao, buộc phải dùng lại Biktarvy. Dù vậy, RNA/DNA HIV trong tế bào máu gốc người hiến vẫn âm tính, đáp ứng tế bào T và kháng thể không tăng. Điều này cho thấy virus tái xuất từ kho dự trữ tế bào nhiễm trước ghép, nhưng tế bào mới “thực sự được bảo vệ”, Rubinstein nhận định.
Sau gần hai năm dùng lại ART, bệnh nhân thử ngừng thuốc lần hai và vẫn ổn định sau 10 tháng. Đây là ca đầu tiên duy trì thuyên giảm dù tái phát virus khi ngừng ART lần đầu sau ghép. Nhóm nghiên cứu kết luận điều này chứng tỏ tái phát sớm không loại trừ khả năng chữa khỏi chức năng.
“Ca bệnh cho thấy loại bỏ kho dự trữ HIV khó khăn thế nào”, Rubinstein nói với phóng viên, đồng thời nhấn mạnh: “Tế bào CCR5-delta-32 có khả năng bảo vệ đáng kinh ngạc. Ngay cả khi virus tái phát, vẫn có cơ hội thuyên giảm.”
Bệnh nhân Oslo
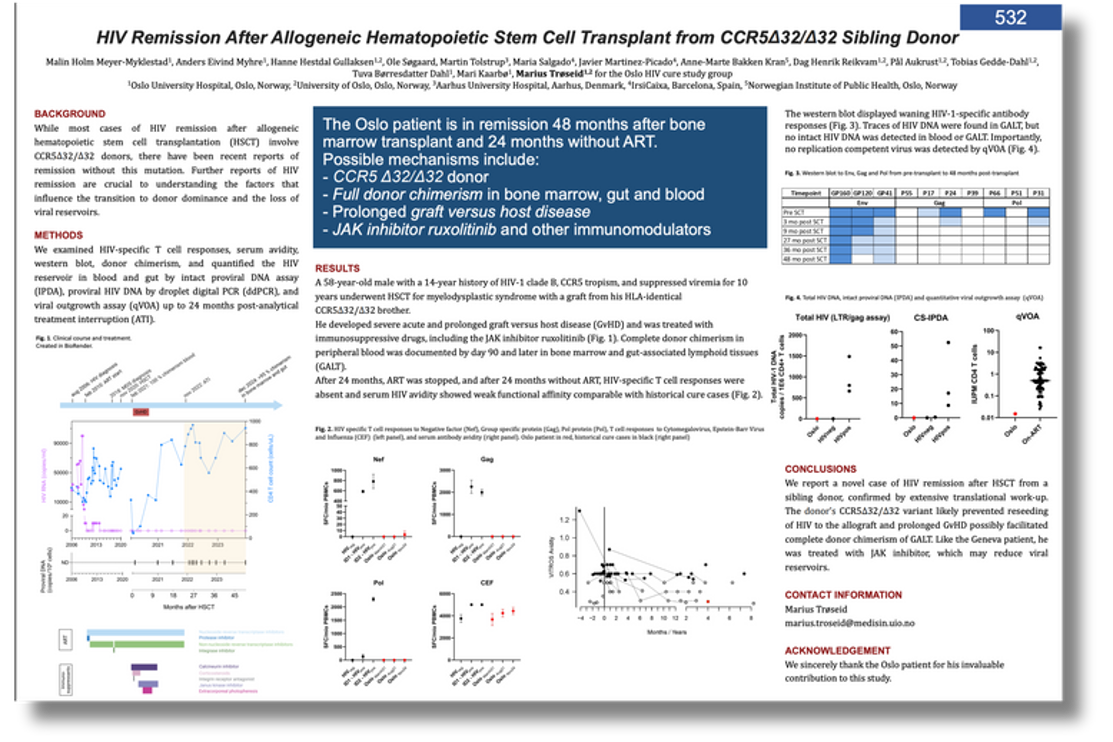
Trøseid mô tả trường hợp nam 58 tuổi nhiễm HIV 14 năm trước khi chẩn đoán hội chứng rối loạn sinh tủy (tiền AML). Bệnh nhân mang một bản CCR5-delta-32 được ghép tế bào gốc từ anh trai có đột biến kép. Sau ghép, ông bị GVHD nặng kéo dài, được điều trị bằng thuốc ức chế miễn dịch gồm ruxolitinib – loại thuốc “bệnh nhân Geneva” cũng dùng. Xét nghiệm cho thấy tế bào hiến đã thay thế hoàn toàn hệ miễn dịch. Tải lượng virus huyết tương âm tính liên tục, bệnh nhân ngừng ART sau hai năm ghép.
Hai năm ngừng thuốc, virus vẫn không phát hiện, đáp ứng tế bào T CD4/CD8 đặc hiệu HIV biến mất, nồng độ kháng thể giảm dần – dấu hiệu cho thấy “không còn virus kích hoạt hệ miễn dịch”, Trøseid nhận định. Dù phát hiện vết DNA HIV trong mô lympho ruột, không tìm thấy DNA HIV nguyên vẹn trong máu hay ruột, cũng như virus có khả năng nhân lên trong xét nghiệm phát triển virus. “Nhờ ‘bệnh nhân Oslo’, chúng tôi có thêm bằng chứng quý giá về tình trạng thuyên giảm HIV sau ghép tế bào gốc tạo máu”, nhóm nghiên cứu kết luận.
Manh mối hướng tới phương pháp chữa trị
Các nhà khoa học vẫn đang tìm hiểu tại sao một số người khỏi HIV sau ghép tế bào gốc trong khi nhiều ca khác thất bại, và dường như không có yếu tố quyết định duy nhất nào ở tất cả trường hợp.
Hầu hết bệnh nhân nhận tế bào gốc từ người hiến đột biến kép CCR5-delta-32, nhưng một số có người hiến chỉ một hoặc không có bản sao đột biến. Một số trải qua điều trị tiền ghép cường độ cao, số khác dùng phác đồ nhẹ nhàng hơn. Tương tự, vài người bị GVHD nặng nhưng số khác không. Kích thước kho dự trữ virus trước ghép có thể đóng vai trò, trong khi tác động của ruxolitinib vẫn chưa rõ ràng.
“Cho đến nay, CCR5 được chú ý nhiều, nhưng sau ‘bệnh nhân Geneva’, giảm kho dự trữ virus đang là trọng tâm”, Trøseid nói. Rubinstein đồng tình: “Cuối cùng, chúng ta phải phân tích tổng thể các trường hợp để tìm câu trả lời cơ chế.”
Biến đổi gene tế bào gốc
Ghép tế bào gốc là thủ thuật phức tạp, tốn kém, chỉ dành cho bệnh nhân ung thư giai đoạn cuối nên không khả thi với đa số người nhiễm HIV toàn cầu. Do đó, giới nghiên cứu đang tìm cách khác bảo vệ tế bào khỏi HIV, bao gồm dùng CRISPR chỉnh sửa gene để vô hiệu hóa hoặc xóa thụ thể CCR5 trên tế bào miễn dịch. Tuy nhiên, theo TS. Timothy Henrich từ Đại học California San Francisco và cộng sự, cần chiến lược mở rộng liệu pháp gene vượt ra ngoài CCR5 để nhắm vào nhiều giai đoạn nhân lên của HIV.
Trong nghiên cứu khác tại CROI, nhóm Henrich biến đổi tế bào gốc từ bệnh nhân HIV được ghép tự thân điều trị lymphoma. Khác với ghép dị thân (dùng tế bào người hiến), ghép tự thân thu hoạch tế bào gốc của chính bệnh nhân trước hóa/xạ trị, sau đó truyền lại cơ thể.
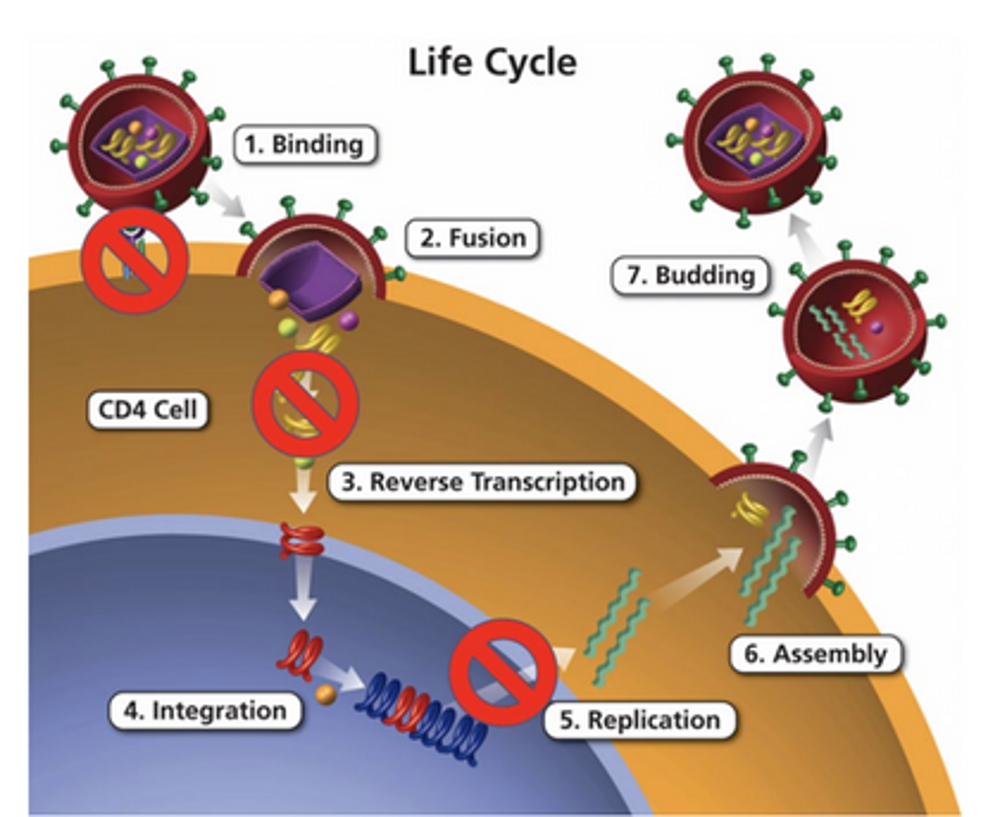
Trong thử nghiệm giai đoạn I này, vector lentivirus được dùng để đưa ba gene kháng HIV vào tế bào gốc tự thân: CCR5 shRNA (ngăn virus xâm nhập), gene TRIM5alpha lai (ngăn cởi bỏ vỏ capsid và phiên mã ngược), mồi nhử TAR (ngăn kích hoạt phiên mã). Ba nhóm gồm 11 bệnh nhân nhận tỷ lệ kết hợp tế bào biến đổi gene và không biến đổi khác nhau. Tất cả đạt ghép tạng “thành công và ổn định” sau 1-2 năm, tế bào máu ngoại vi biến đổi tồn tại lâu dài. Một số có tải lượng virus phát hiện được ở mức thấp ngắt quãng hoặc liên tục sau ghép. Một bệnh nhân có tải lượng virus âm tính chọn ngừng ART sau 42 tháng ghép. Xét nghiệm cho thấy khoảng 75% tế bào biến đổi gene được bảo vệ khỏi HIV trong thời gian ngừng thuốc. Người này tái phát virus, phải dùng lại thuốc sau 8 tuần và nhanh chóng đạt tải lượng âm tính. “Biến đổi gene tế bào gốc tạo máu ở bệnh nhân HIV cần ghép tự thân điều trị lymphoma nhắm vào ba giai đoạn trong vòng đời HIV giúp tế bào lympho biến đổi tồn tại lâu dài”, Henrich và cộng sự kết luận.
Nghiên cứu này vẫn ở giai đoạn rất sớm. Dù ghép tự thân không cần tìm người hiến phù hợp và ít rủi ro GVHD hơn ghép dị thân, nó vẫn chỉ áp dụng cho người cần ghép tế bào gốc chữa ung thư. Tuy nhiên, công trình góp thêm bằng chứng hướng tới phương pháp chữa khỏi chức năng HIV áp dụng rộng rãi trong tương lai.
(Dịch từ https://www.aidsmap.com)