Category: Ứng dụng Tế bào gốc
-
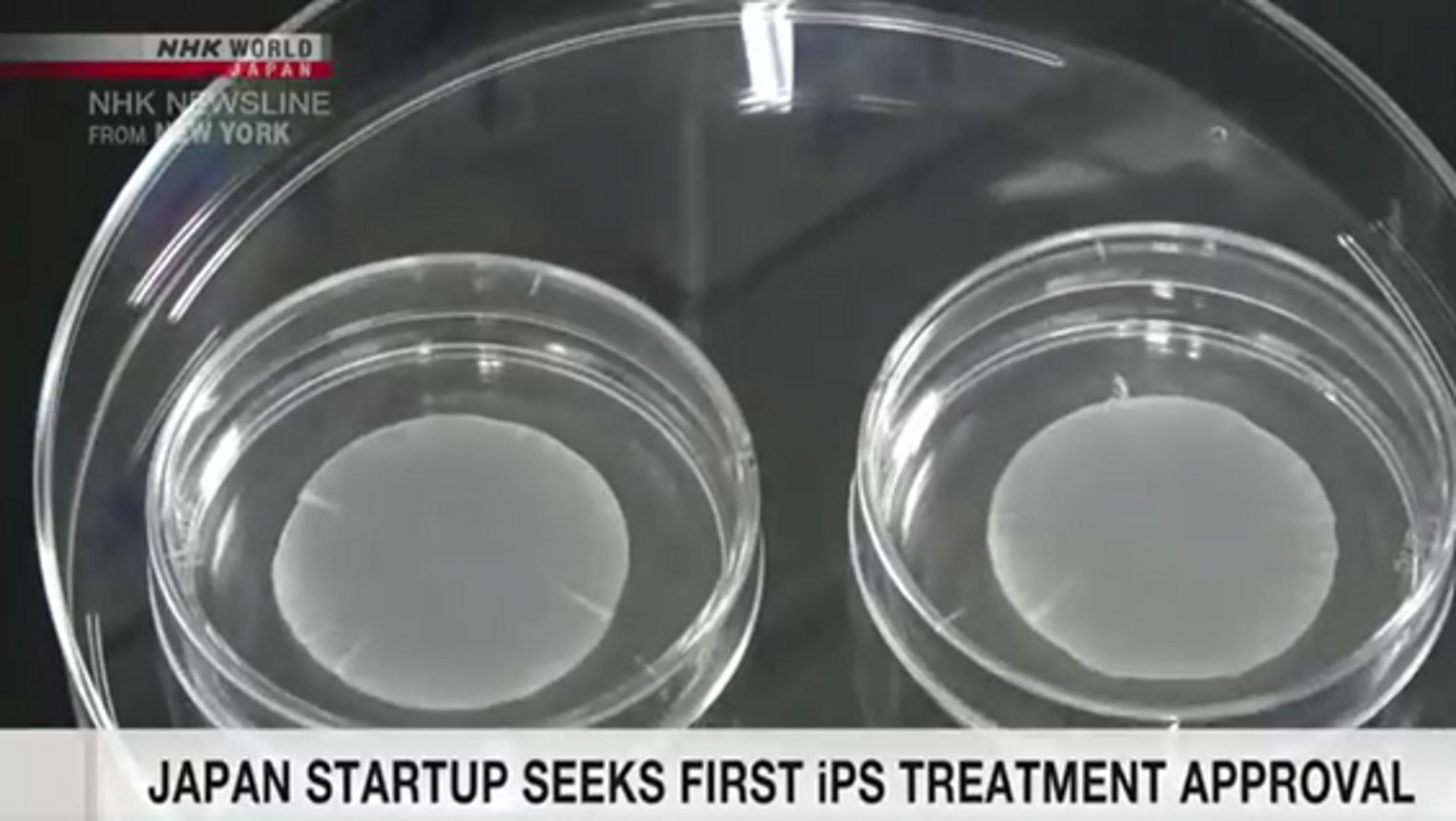
Công ty khởi nghiệp Nhật Bản xin cấp phép sử dụng tấm tế bào tim từ tế bào iPS
Một công ty khởi nghiệp Nhật Bản thông báo đã nộp đơn lên Bộ Y tế xin phê duyệt sản xuất và thương mại hóa tấm tế bào cơ tim được tạo ra từ tế bào gốc đa năng cảm ứng (iPS), ứng dụng trong điều trị bệnh tim. Cuorips – startup được thành lập…
-
CHA Bio F&C và Cosmecca hợp tác cùng phát triển thành phần dưỡng da từ tế bào gốc
CHA Bio F&C, công ty con của Tập đoàn CHA Bio, vừa ký kết thỏa thuận hợp tác R&D kéo dài 2 năm với Cosmecca Korea để cùng phát triển các thành phần mỹ phẩm sinh học có khả năng kích hoạt tế bào gốc da — đánh dấu sự kết hợp giữa y học…
-
Tế bào gốc có thể giải quyết các triệu chứng hành vi ở bệnh nhân Alzheimer không?
Khi bệnh Alzheimer tiến triển, nhiều bệnh nhân phát triển các vấn đề hành vi nghiêm trọng như kích động, hung hăng, rối loạn giấc ngủ và hành vi tình dục bất thường, ảo giác và hoang tưởng. Những triệu chứng này có thể gây căng thẳng tột độ cho bệnh nhân và người chăm…
-
Thỏa thuận lớn đầu tiên về liệu pháp exosome tại Hàn Quốc
Brexogen, một công ty công nghệ sinh học hàng đầu chuyên về liệu pháp dựa trên exosome, đã công bố thỏa thuận chuyển giao công nghệ và cấp phép với BMI Korea cho BxC-I17e, một liệu pháp tiêm tiên tiến dựa trên exosome. Thỏa thuận này đánh dấu thương vụ cấp phép lớn đầu tiên…
-
Genèse Labs France Giới Thiệu Giải Pháp Chăm Sóc Da Từ Exosome – Exoluma
Ngày 20 tháng 2 năm 2025, Genèse Labs France vui mừng thông báo ra mắt Exoluma, một sản phẩm chăm sóc da ứng dụng công nghệ exosome, được thiết kế để hỗ trợ tái tạo, phục hồi và điều trị lão hóa da. Công thức kết hợp công nghệ exosome tiên tiến cùng các thành…
-
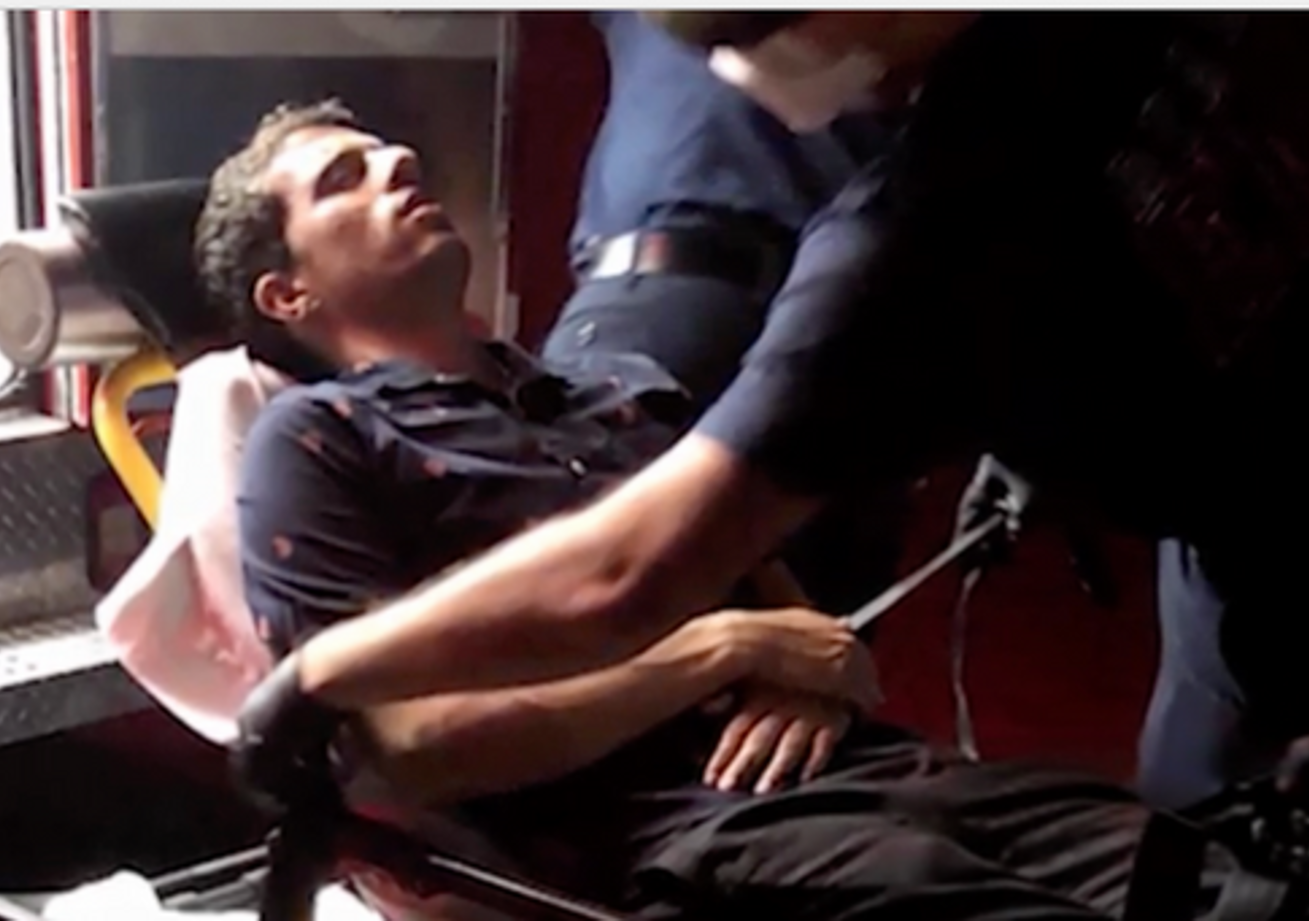
Cấy ghép tế bào gốc giúp bệnh nhân bị mù mắt trái do chấn thương phục hồi thị lực
Nick Kharufeh cho biết anh từng nghĩ mình sẽ không bao giờ nhìn thấy được bằng mắt trái nữa sau một vết thương nhiều năm trước. Giờ đây, anh đang tích cực vận động để mọi người biết đến phương pháp đã giúp anh lấy lại thị giác. Vào ngày 4 tháng 7 năm 2020,…
-
MEDIPOST, Inc. Mở Rộng Tại Hoa Kỳ, Hướng Đến Thử Nghiệm Lâm Sàng Giai Đoạn III Của CARTISTEM®
MEDIPOST, Inc., một công ty hàng đầu toàn cầu về liệu pháp tế bào gốc, vừa công bố bổ nhiệm năm giám đốc cấp cao, mỗi người sở hữu hàng thập kỷ kinh nghiệm trong lĩnh vực sinh học và liệu pháp tế bào & gene. Đội ngũ lãnh đạo mới này đánh dấu một…
-
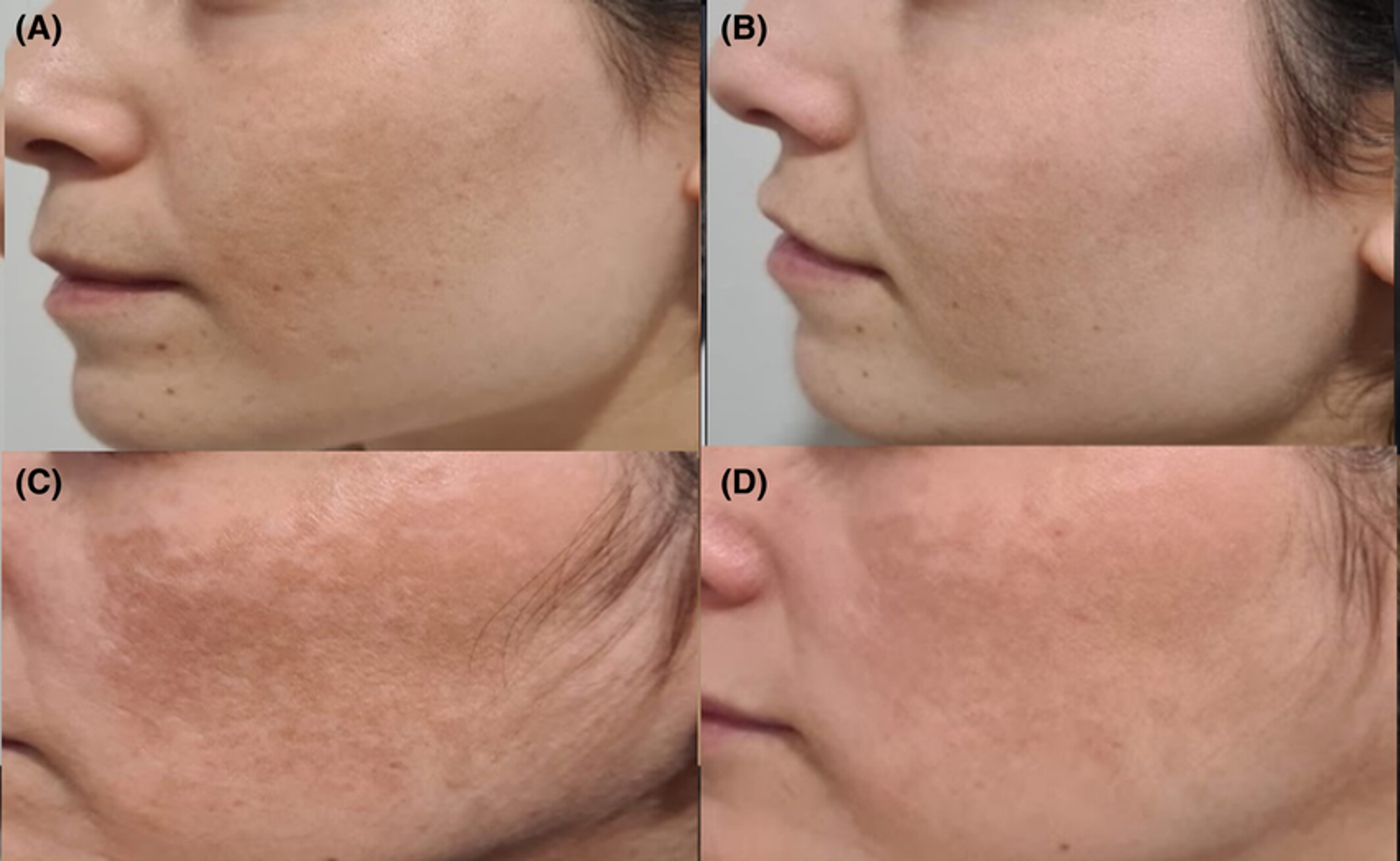
Điều trị nám da bằng huyết tương giàu tiểu cẩu
Một nghiên cứu gần đây được công bố trên Tạp chí Da liễu Thẩm mỹ chỉ ra rằng huyết tương giàu tiểu cầu (PRP) là một phương pháp điều trị hiệu quả và an toàn cho nám da. Nám da là một rối loạn sắc tố da phổ biến, dai dẳng và tái phát với…
-
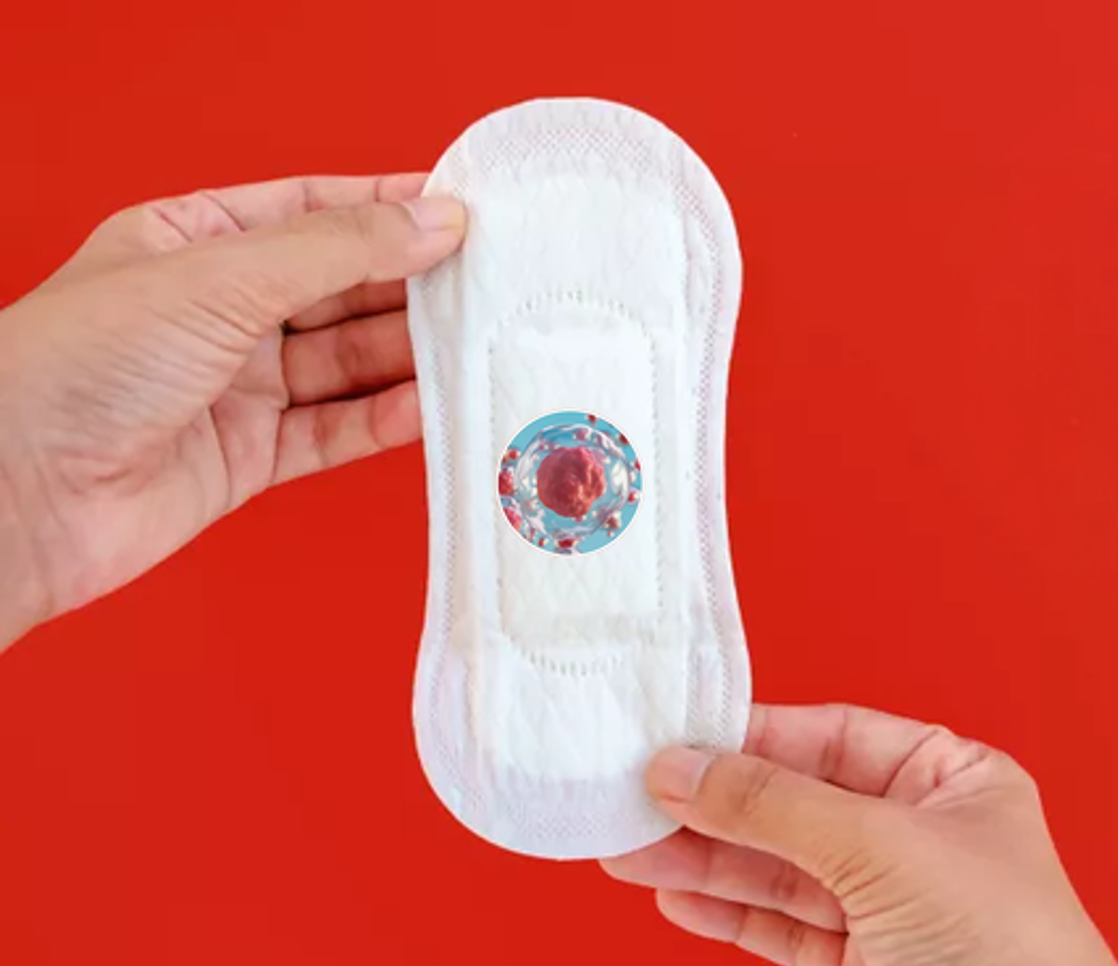
Nghiên cứu điều trị bệnh Alzheimer bằng tế bào gốc từ máu kinh nguyệt
Đây là một chủ đề khiến các quý ông trên khắp thế giới cảm thấy ngại ngùng — nhưng nó có thể cứu sống họ. Các nhà khoa học đang cố gắng tìm phương pháp chữa bệnh Alzheimer đang thử nghiệm một nguồn mới không ngờ: máu kinh nguyệt. Có thể ‘tăng cường’ một loại…
-
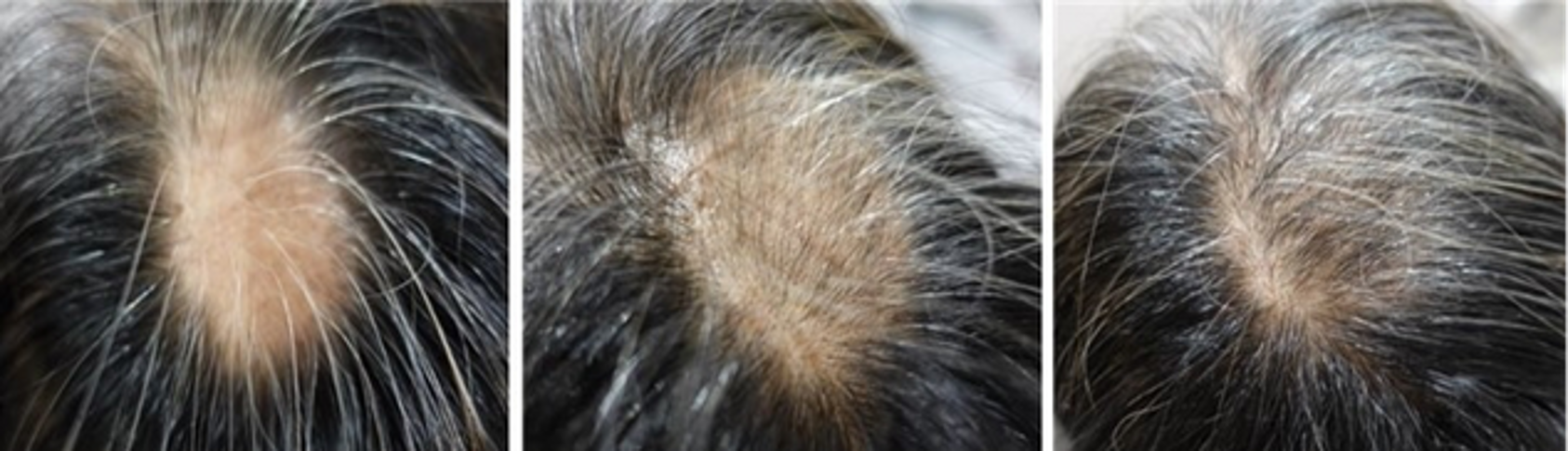
Miracell giới thiệu phương pháp điều trị rụng tóc đột phá bằng tế bào gốc
Công ty nghiên cứu tế bào gốc ở Hàn Quốc, Miracell, thông báo vào thứ Năm, 23/1/2025 rằng họ đã tổ chức một phiên họp giới thiệu các phương pháp điều trị rụng tóc tiên tiến bằng công nghệ tế bào gốc, nhằm đáp ứng số lượng ngày càng tăng người Hàn Quốc bị ảnh…