Category: Tin tức
-
Thỏa thuận hợp tác: Carisma và Moderna
Carisma Therapeutics (Pennsylvania, Hoa Kỳ; https://carismatx.com), một công ty dược phẩm sinh học giai đoạn lâm sàng tập trung vào việc phát hiện và phát triển các liệu pháp miễn dịch đột phá, đã công bố mở rộng quan hệ hợp tác về công nghệ đại thực bào và bạch cầu đơn nhân mang thụ…
-
Hợp tác giữa Acepodia và Pfizer
Acepodia (California, Hoa Kỳ; www.acepodia.com) là công ty công nghệ sinh học giai đoạn lâm sàng, phát triển các liệu pháp tế bào đầu tiên với nền tảng công nghệ liên hợp tế bào-kháng thể (ACC) và tế bào T gamma delta 2 (γδ2) độc đáo. Gần đây, họ thông báo đã ký kết hợp…
-
34 triệu USD cho nghiên cứu các liệu pháp tế bào gốc cho viêm khớp và các tình trạng khác
Chính phủ Úc đang đầu tư 34,5 triệu USD vào quỹ nghiên cứu để thử nghiệm các phương pháp điều trị và liệu pháp mới nhằm khai thác sức mạnh của tế bào gốc để cải thiện kết quả điều trị cho bệnh nhân. Tiến bộ nghiên cứu trong 10 năm qua đã cho thấy…
-
Chi phí liệu pháp tế bào gốc trên thế giới năm 2024
Chi phí điều trị bằng tế bào gốc khác nhau rất nhiều tùy thuộc vào địa điểm, bao gồm các khu vực như Mỹ, Mexico, Panama và Quần đảo Cayman. Chi phí điều trị bằng tế bào gốc có thể dao động đáng kể tùy thuộc vào một số yếu tố, chẳng hạn như loại…
-
10 năm của liệu pháp gen và tế bào trên thế giới 2014-2024: Một kỉ nguyên chuyển đổi
Liệu pháp tế bào và gen: từ tiềm năng đến hiện thực Vào năm 2014, lĩnh vực này vẫn đang ở giai đoạn sơ khai, với chỉ một vài liệu pháp được phê duyệt và nhiều phương pháp điều trị thử nghiệm. Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA; MD, USA)…
-
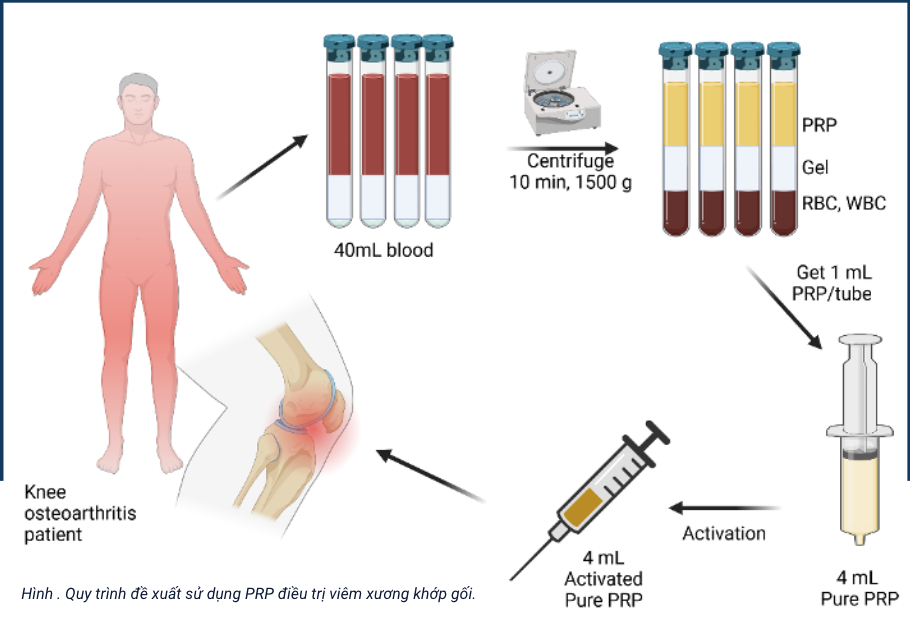
Sử dụng huyết tương giàu tiểu cầu trong điều trị viêm xương khớp: cập nhật những bằng chứng ủng hộ mới
Đỗ Minh Nghĩa, Nguyễn Trọng Hòa, Vũ Bích Ngọc, Phạm Văn Phúc Viện Tế bào gốc, Trường Đại học Khoa học tự nhiên, Đại học Quốc gia Tp.HCM Email: [email protected] Tóm tắt Huyết tương giàu tiểu cầu là một trong những chế phẩm sinh học được sử dụng rộng rãi trong thời gian gần đây,…
-
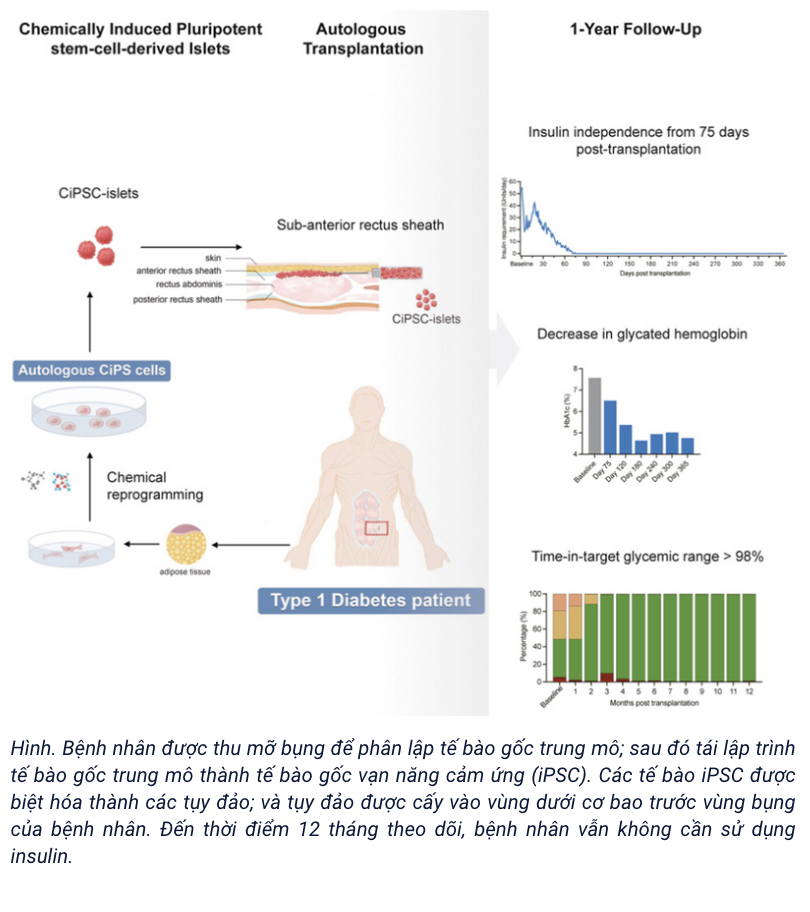
Liệu pháp tế bào gốc điều trị thành công bệnh tiểu đường type 1 lần đầu tiên trên thế giới
Một phát hiện đột phá gần đây đã mang lại hy vọng cho hàng triệu người sống chung với bệnh tiểu đường type 1 trên khắp thế giới. Lần đầu tiên trên thế giới, các nhà khoa học đã sử dụng liệu pháp tế bào gốc để điều trị dứt điểm bệnh tiểu đường type…
-
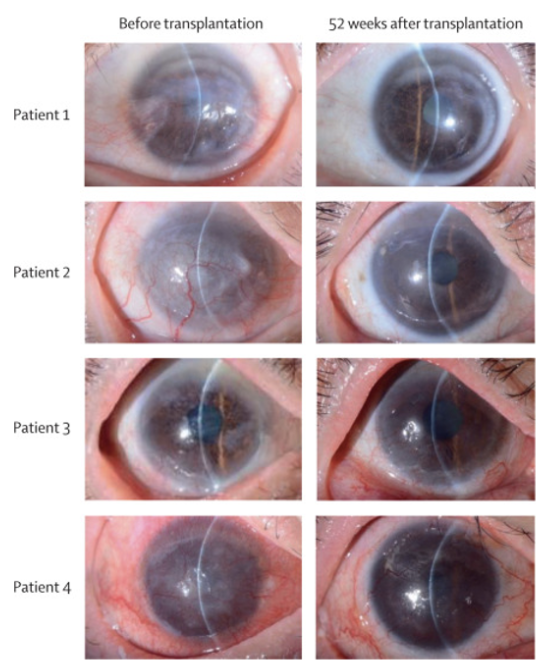
Phục hồi thị lực bằng ghép tế bào gốc: ghi nhận lần đầu trên thế giới
Thế giới lần đầu tiên: Ghép tế bào gốc khôi phục thị lực cho nhiều người Một ca cấy ghép tế bào gốc đã cải thiện đáng kể tầm nhìn của ba người có tổn thương nghiêm trọng ở giác mạc. Cuộc thử nghiệm lâm sàng, diễn ra tại Nhật Bản, là lần đầu tiên…
-
Ryoncil – thuốc tế bào gốc trung mô đầu tiên được FDA Mĩ cấp phép
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) cấp phép cho thuốc tế bào gốc trung mô đầu tiên để điều trị bệnh ghép chống chủ cấp tính không đáp ứng với steroid vào ngày 18/12/2024. Ryoncil được sản xuất bởi Công ty Mesoblast Inc. trở thành thuốc tế bào gốc…
-
Năm 2024 – năm thành công của liệu pháp tiên tiến của Mĩ
Năm 2024, lần đầu tiên trong lịch sử, FDA Mĩ đã chấp thuận cấp phép cho nhiều sản phẩm thuộc nhóm các sản phẩm tiên tiến trong điều trị bệnh, gồm liệu pháp tế bào, liệu pháp gen và liệu pháp tế bào gốc. Trong năm này, lần đầu tiên tế bào gốc trung mô…