Category: Tin tức
-
Acepodia
Acepodia (California, Mỹ; www.acepodia.com), một công ty công nghệ sinh học giai đoạn lâm sàng chuyên phát triển các liệu pháp tế bào đột phá, đã nhận được sự chấp thuận từ FDA Hoa Kỳ cho đơn đăng ký Thuốc mới (IND) đối với ACE1831 – ứng viên hàng đầu của công ty trong điều…
-
CHOP và INCA
Bệnh viện Nhi đồng Philadelphia (CHOP; Pennsylvania, Mỹ; www.chop.edu) đã hợp tác với Viện Ung thư Quốc gia Brazil (INCA; Brazil; www.inca.gov.br/en) để thiết lập một trung tâm sản xuất tế bào CAR-T hiện đại tại INCA. Sáng kiến này nhằm mở rộng khả năng tiếp cận liệu pháp miễn dịch tiên tiến cho các…
-
Answer ALS
Answer ALS (Los Angeles, Mỹ; www.answerals.org) và Cedars-Sinai (California, Mỹ; www.cedars-sinai.org) đã cùng công bố sự hoàn thành và ra mắt kho dữ liệu lớn nhất về tế bào gốc iPSC và thông tin sinh học liên quan đến bệnh xơ cứng teo cơ một bên (ALS). Kho dữ liệu này bao gồm thông tin…
-
Thỏa thuận hợp tác: Vyriad và Novartis
Vyriad (MN, USA; https://vyriad.com), một công ty công nghệ sinh học đang trong giai đoạn lâm sàng phát triển thế hệ liệu pháp gen trúng đích tiếp theo, đã công bố hợp tác chiến lược với Novartis (Thụy Sĩ; www.novartis.com) để để khám phá và phát triển các liệu pháp tế bào T CAR trong…
-
2. Thỏa thuận hợp tác: Oxford Nanopore và UK Biobank
Oxford Nanopore Technologies (Anh; https://nanoporetech.com), nhà cung cấp công nghệ cảm biến phân tử thế hệ mới dựa trên nanopore, đã công bố hợp tác với UK Biobank (Anh; www.ukbiobank.ac.uk) để xây dựng bộ dữ liệu ngoài di truyền (epigenetics) toàn diện và quy mô lớn đầu tiên trên thế giới. Dự án này sử…
-
Thỏa thuận hợp tác và cấp phép: Alloy và Takeda
Alloy Therapeutics (MA, USA; https://alloytx.com), một công ty công nghệ sinh học tập trung vào việc dân chủ hóa quyền truy cập vào các công nghệ phát hiện thuốc tiên tiến, đã ký kết thỏa thuận hợp tác chiến lược và cấp phép với Takeda Pharmaceutical (Nhật Bản; www.takeda.com). Thỏa thuận này nhằm phát triển…
-
MEDIPOST, Inc. Mở Rộng Tại Hoa Kỳ, Hướng Đến Thử Nghiệm Lâm Sàng Giai Đoạn III Của CARTISTEM®
MEDIPOST, Inc., một công ty hàng đầu toàn cầu về liệu pháp tế bào gốc, vừa công bố bổ nhiệm năm giám đốc cấp cao, mỗi người sở hữu hàng thập kỷ kinh nghiệm trong lĩnh vực sinh học và liệu pháp tế bào & gene. Đội ngũ lãnh đạo mới này đánh dấu một…
-
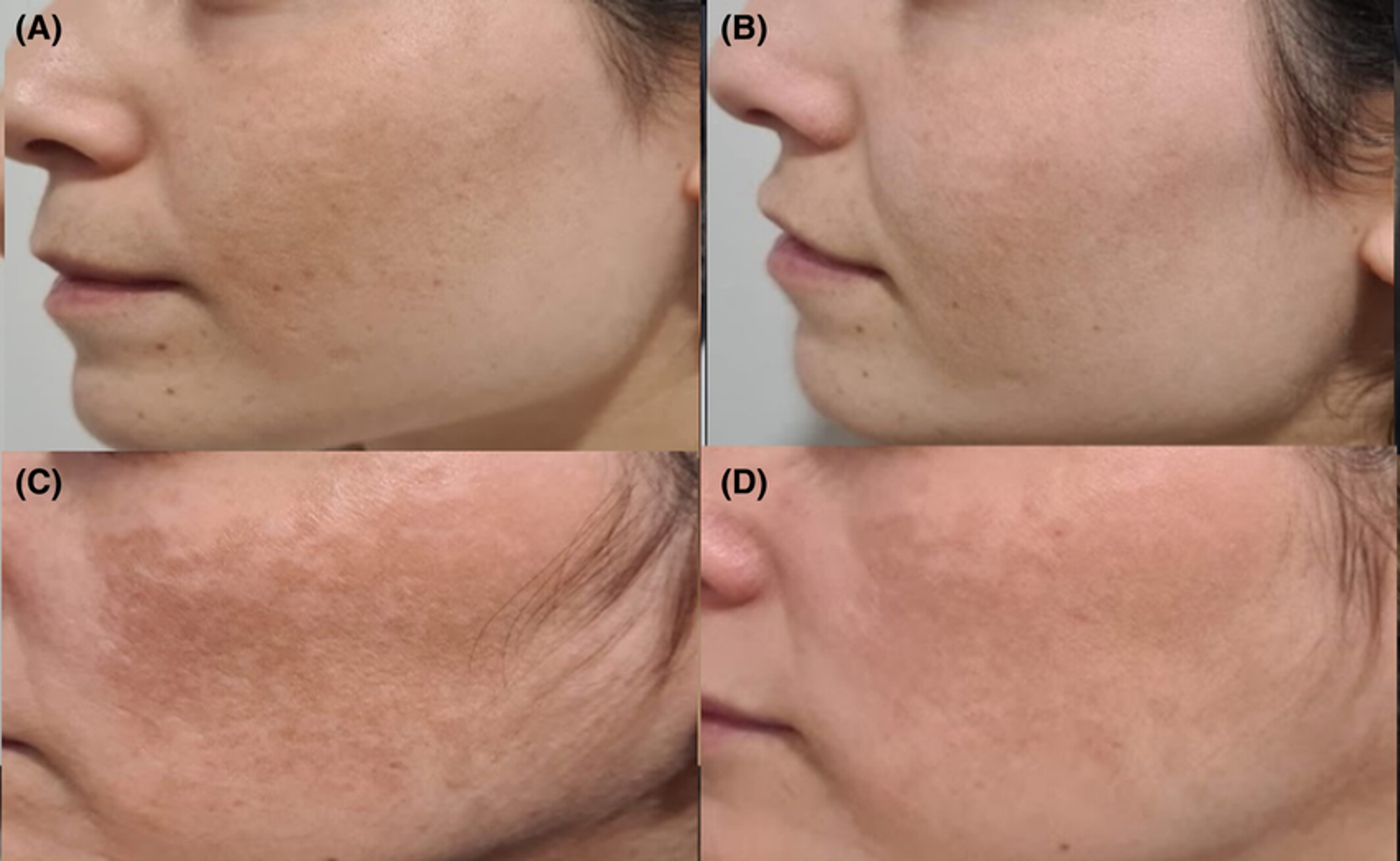
Điều trị nám da bằng huyết tương giàu tiểu cẩu
Một nghiên cứu gần đây được công bố trên Tạp chí Da liễu Thẩm mỹ chỉ ra rằng huyết tương giàu tiểu cầu (PRP) là một phương pháp điều trị hiệu quả và an toàn cho nám da. Nám da là một rối loạn sắc tố da phổ biến, dai dẳng và tái phát với…
-
Nghiên cứu điều trị bệnh Alzheimer bằng tế bào gốc từ máu kinh nguyệt
Đây là một chủ đề khiến các quý ông trên khắp thế giới cảm thấy ngại ngùng — nhưng nó có thể cứu sống họ. Các nhà khoa học đang cố gắng tìm phương pháp chữa bệnh Alzheimer đang thử nghiệm một nguồn mới không ngờ: máu kinh nguyệt. Có thể ‘tăng cường’ một loại…
-
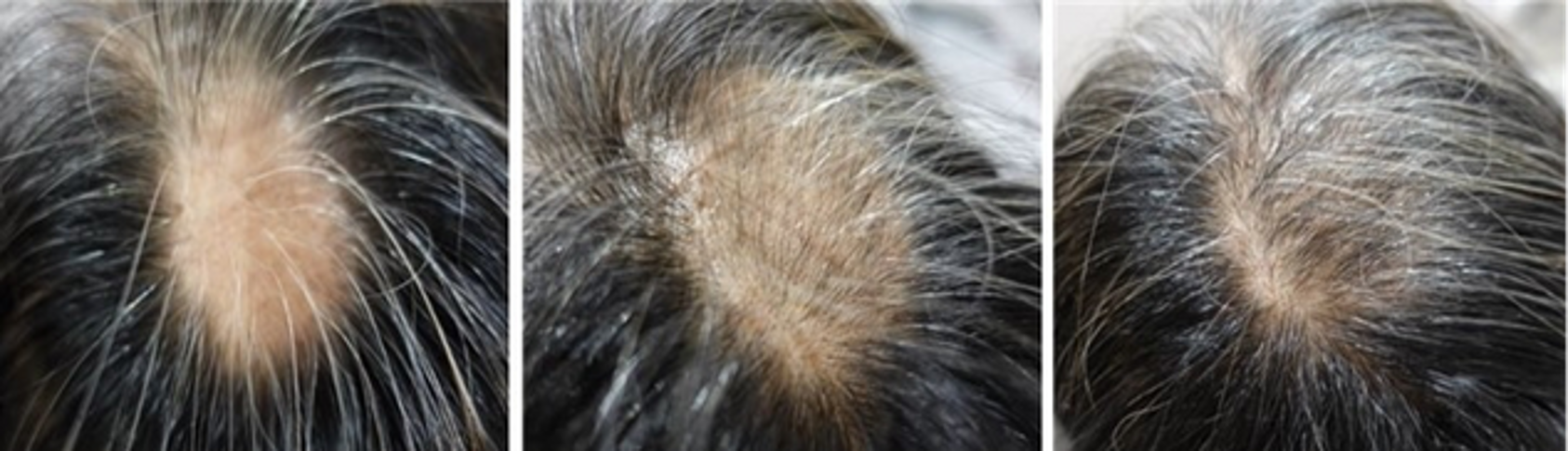
Miracell giới thiệu phương pháp điều trị rụng tóc đột phá bằng tế bào gốc
Công ty nghiên cứu tế bào gốc ở Hàn Quốc, Miracell, thông báo vào thứ Năm, 23/1/2025 rằng họ đã tổ chức một phiên họp giới thiệu các phương pháp điều trị rụng tóc tiên tiến bằng công nghệ tế bào gốc, nhằm đáp ứng số lượng ngày càng tăng người Hàn Quốc bị ảnh…