Category: Tế bào gốc Thế giới
-
Tiến Bộ Mới Trong Nghiên Cứu Tế Bào Gốc: Vai Trò Của SIX2 Trong Ung Thư Tuyến Tiền Liệt Không Phụ Thuộc Thụ Thể Androgen
Một nhóm nghiên cứu từ Đại học Đông Phần Lan vừa công bố những phát hiện quan trọng về vai trò của yếu tố phiên mã SIX2 trong điều chỉnh sự linh hoạt của tế bào ung thư tuyến tiền liệt không phụ thuộc vào thụ thể androgen (AR). Nghiên cứu này mở ra hy…
-
Tế Bào Gốc – “Người Dọn Dẹp” Thông Minh Giúp Mô Luôn Khỏe Mạnh
Một phát hiện đáng kinh ngạc từ các nhà khoa học Đại học Rockefeller và Yale (Mỹ) đã làm thay đổi cách nhìn nhận về tế bào gốc. Không chỉ đóng vai trò tái tạo mô, tế bào gốc còn đảm nhận nhiệm vụ “dọn dẹp” các tế bào chết, giúp ngăn ngừa viêm nhiễm…
-
Đột Phá cấu trúc Hydrogel 3D mô phỏng sinh học: Bước Tiến Mới Trong Tái Tạo Xương
Trong nỗ lực giải quyết những hạn chế của phương pháp ghép xương truyền thống, nhóm nghiên cứu từ Bệnh viện Nhân Dân Tỉnh Giang Tô và Đại học Y Quảng Đông vừa công bố một phát minh đột phá: giàn giáo hydrogel composite 3D mô phỏng sinh học, có khả năng thúc đẩy tái…
-
Các Tiến Bộ Trong Nghiên Cứu Về Galectin-8: Hy Vọng Mới Trong Điều Trị Ung Thư Và Bệnh Mạch Máu
Nghiên cứu khoa học không ngừng mở ra những góc nhìn mới về cơ chế sinh học, đặc biệt trong lĩnh vực hình thành mạch máu (angiogenesis). Gần đây, Galectin-8 (Gal-8) – một protein thuộc họ galectin – đã nổi lên như một nhân tố quan trọng khi tương tác với yếu tố tăng trưởng…
-
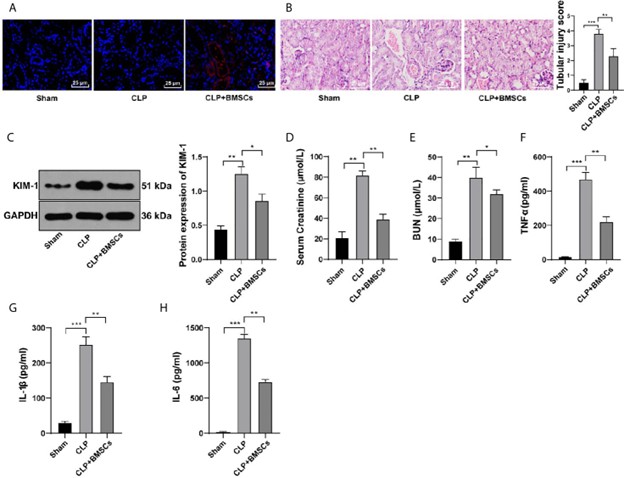
Tế bào gốc trung mô có nguồn gốc từ tủy xương cải thiện tình trạng tổn thương thận cấp tính do nhiễm trùng huyết
Tế bào gốc trung mô từ tủy xương (BMSC) đóng vai trò quan trọng trong điều hòa miễn dịch và tái tạo mô nhờ khả năng biệt hóa thành nhiều loại tế bào khác nhau. BMSC có thể ức chế phản ứng viêm và thúc đẩy quá trình mitophagy, qua đó cải thiện tổn thương…
-
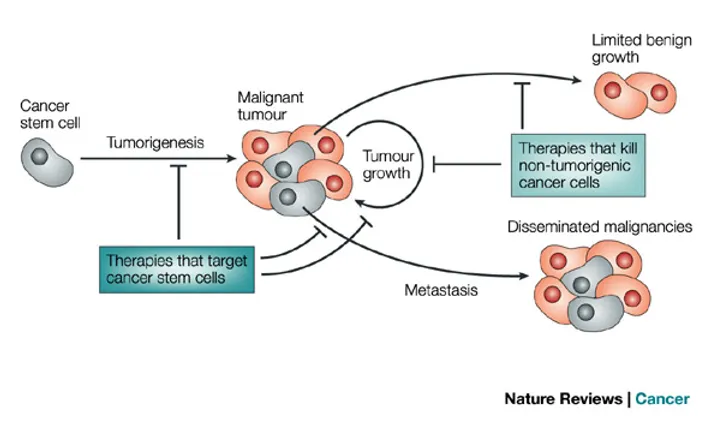
Kết quả thử nghiệm lâm sàng pha I liệu pháp điều trị tấn công trúng đích tế bào gốc ung thư
Kết quả thử nghiệm lâm sàng pha I sử dụng thuốc OMP-54F28 (FZD8-Fc) để tấn công trúng đích tế bào gốc ung thư đã được công bố. Kết quả cho thấy thuốc điều trị được tiếp nhận tốt, nhiều bệnh nhân ung thư giai đoạn cuối ổn định sức khỏe trong hơn 6 tháng. 3…
-
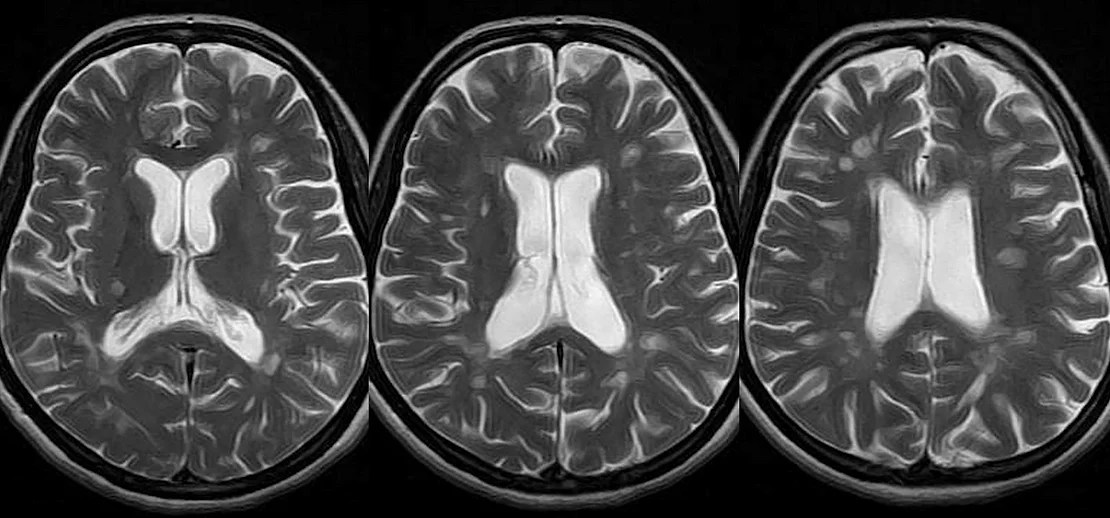
Điều trị đột quỵ bằng ghép tế bào gốc: kết quả đầy bất ngờ
Một nghiên cứu quy mô pilot tiến hành ở Scotland tại Viện Khoa học Thần kinh, Bệnh viện Southern General, lần đầu tiên sử dụng tế bào gốc thần kinh đã biến đổi di truyền để điều trị đột quỵ. Dòng tế bào mang tên ReN001. Nghiên cứu tiến hành trên 12 bệnh nhân đột…
-
Phương pháp mới giúp tạo tế bào cơ tim từ tế bào gốc
Phương pháp trưởng thành tế bào cơ tim người bằng cách mô phỏng môi trường sinh trưởng tự nhiên của các tế bào cơ tim đồng thời áp dụng xung điện nhằm bắt chước nhịp tim của bào thai người. Trong nghiên cứu điều trị bệnh tim mạch, việc không thể lấy tế bào tim…
-
Tế bào não trưởng thành có nguồn gốc từ da: một hy vọng mới
Các căn bệnh khó nghiên cứu như bệnh Alzheimer, chứng tâm thần phân liệt, bệnh tự kỷ giờ đây có thể được tiếp cận an toàn và hiệu quả nhờ vào một phương pháp mới nhằm thu nhận tế bào não trưởng thành còn được gọi là tế bào thần kinh (neuron) từ tế bào…
-
Bảo quản tế bào gốc ở dạng khối cầu: Phương pháp mới có thể bảo quản ở nhiệt độ phòng
Khoa Khoa học Y tế, Trường Đại học Macau (FHS-UM) đã phát triển một công nghệ đột phá cho phép lưu trữ tế bào gốc ở nhiệt độ trong phòng trong 07 ngày mà không bị chết. Công nghệ mới này không dựa vào phương pháp bảo quản lạnh truyền thống mà đòi hỏi phải…