Category: Tế bào gốc Thế giới
-
Tế bào gốc thần kinh trưởng thành nhanh hơn trong điều kiện vi trọng lực
Tế bào não duy trì sức khỏe của chúng sau một tháng trên Trạm Không gian Quốc tế nhưng trưởng thành với tốc độ nhanh hơn so với những tế bào trên Trái Đất. Vi trọng lực được biết đến với những tác động lên cơ bắp, xương, hệ miễn dịch và nhận thức; tuy…
-
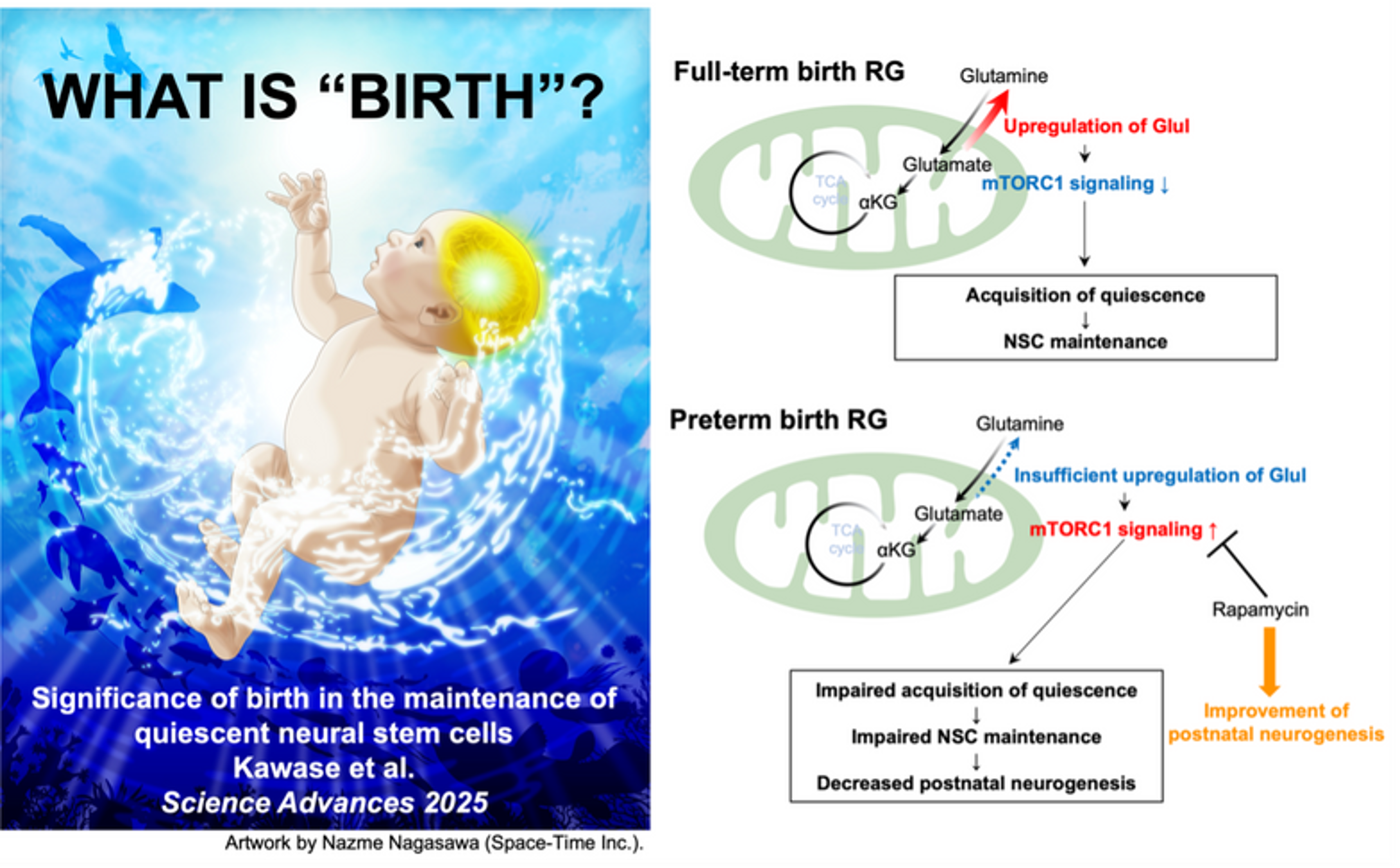
Khám phá tiết lộ tác động của sinh đẻ đến việc duy trì tế bào gốc thần kinh
Một nhóm nghiên cứu từ Đại học Thành phố Nagoya đã làm sáng tỏ tầm quan trọng của sinh đẻ trong việc duy trì tế bào gốc thần kinh (Neural stem cells – NSCs). Kết quả nghiên cứu được công bố trên tạp chí Science Advances. Sinh đẻ là một trong những sự kiện quan…
-
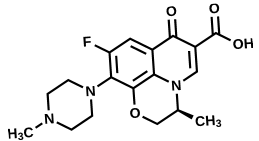
Kháng sinh levofloxacin có tác động bất lợi lên tế bào gốc tủy xương
Nghiên cứu gần đây đã đã phát hiện mới về tác động của levofloxacin, thách thức chúng ta suy nghĩ lại về tác động của loại kháng sinh này lên các tế bào gốc trung mô trong tủy xương. Những tế bào này, quan trọng cho việc sửa chữa mô, đã giảm khả năng sống…
-
OpenAI hợp tác với Retro Biosciences để thiết kế protein tế bào gốc bằng AI
OpenAI đã hợp tác với Retro Biosciences để phát triển GPT-4b micro, mô hình AI đầu tiên của hãng tập trung vào lĩnh vực sinh học, đánh dấu bước tiến mới trong việc khám phá khoa học và nghiên cứu tuổi thọ. Mô hình này đã cho thấy kết quả đầy hứa hẹn trong việc…
-
Cell BioEngines công bố thành lập cơ sở R&D mới để tiếp tục phát triển nền tảng và danh mục các liệu pháp tế bào
Ngày 21 tháng 1, 2025 (theo GLOBE NEWSWIRE), Cell BioEngines, một công ty công nghệ sinh học giai đoạn lâm sàng đang phát triển nền tảng liệu pháp tế bào gốc đồng loài “off-the-shelf” để điều trị các bệnh ung thư huyết học và khối u, công bố rằng họ đã ký hợp đồng thuê…
-
Lần đầu tiên tế bào được chỉnh sửa di truyền để giảm tính sinh miễn dịch được điều trị thử nghiệm trên người
Nền tảng hạ thấp miễn dịch (hypoimmune platform – HIP) của công ty Sana Biotechnology cho phép thực hiện một loạt các chỉnh sửa di truyền lên các tế bào, khiến các tế bào trở nên vô hình (không nhận diện) với hệ miễn dịch của bệnh nhân. Nghiên cứu đầu tiên trên người về…
-
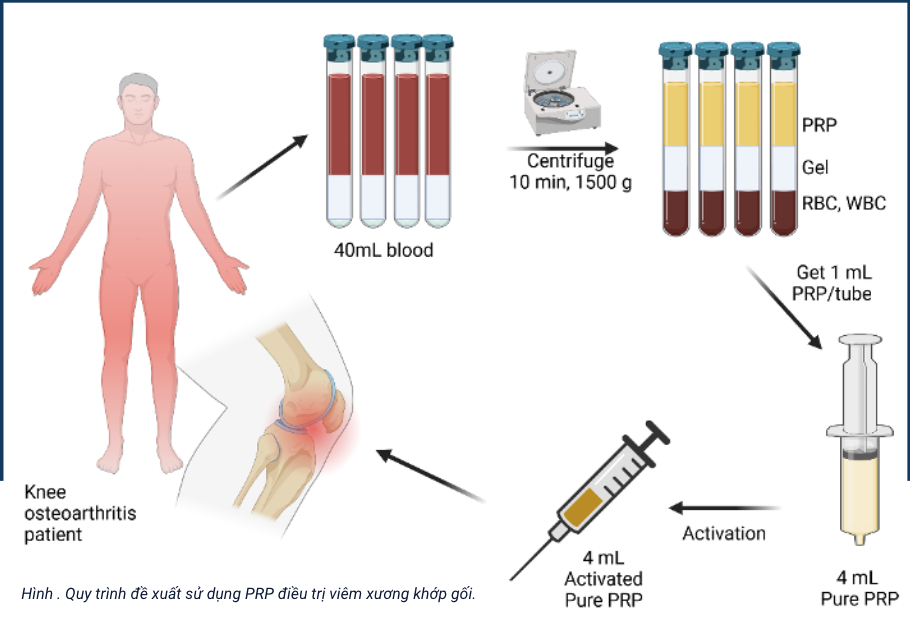
Sử dụng huyết tương giàu tiểu cầu trong điều trị viêm xương khớp: cập nhật những bằng chứng ủng hộ mới
Đỗ Minh Nghĩa, Nguyễn Trọng Hòa, Vũ Bích Ngọc, Phạm Văn Phúc Viện Tế bào gốc, Trường Đại học Khoa học tự nhiên, Đại học Quốc gia Tp.HCM Email: [email protected] Tóm tắt Huyết tương giàu tiểu cầu là một trong những chế phẩm sinh học được sử dụng rộng rãi trong thời gian gần đây,…
-
10 sự kiện quan trọng của tế bào gốc năm 2024
1. Ryoncil – thuốc tế bào gốc trung mô đầu tiên được FDA Mĩ cấp phép lưu hành Ryoncil được sản xuất bởi công ty Mesoblast là thuốc tế bào gốc chứa tế bào gốc trung mô đầu tiên được FDA Mĩ cấp phép lưu hành tại Mĩ vào tháng 12/2024. Ryoncil được chỉ định…
-
Liệu pháp gen cho phép một đứa trẻ điếc nghe được lần đầu tiên
Hầu hết chúng ta chưa bao giờ nghe về gen otoferlin (OTOF), nhưng nó đóng vai trò quan trọng trong khả năng nghe thông qua việc sản xuất một loại protein cho phép âm thanh được truyền từ tai đến não. Một số ít người trên thế giới sinh ra với đột biến di truyền,…
-
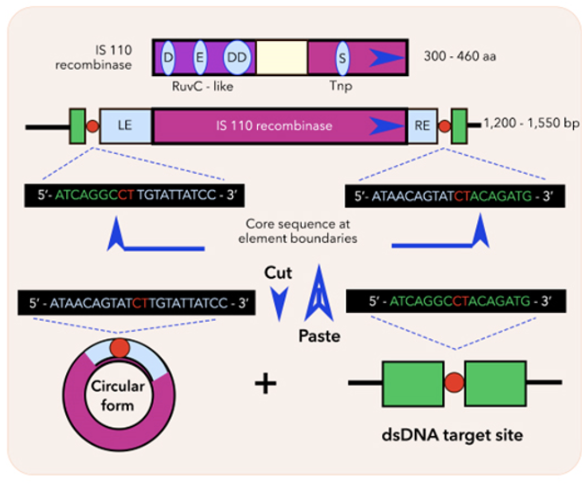
Bridge RNA đại diện cho thế hệ chỉnh sửa gen tiếp theo
Trong khi CRISPR hứa hẹn cách mạng hóa điều trị các bệnh hiếm do đột biến trong một gen duy nhất, các chuyên gia đã tiên phong khám phá lĩnh vực chỉnh sửa gen tiếp theo. Quay lại vào tháng 6, các nhà nghiên cứu tại Viện Arc, một tổ chức nghiên cứu phi lợi…