Category: Nghiên cứu Tế bào gốc
-
RMAT: Quy chế mới trong cấp phép sản phẩm y học tái tạo ở Mĩ: một cơ hội mới cho tế bào gốc của Mĩ
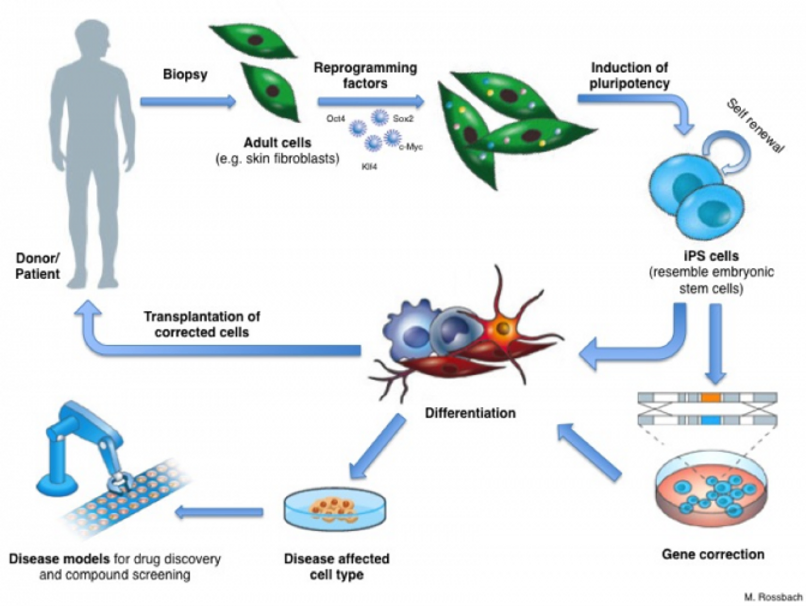
Các lĩnh vực y học tái tạo bao gồm một loạt các sản phẩm sáng tạo, tiên tiến bao gồm liệu pháp tế bào, các sản phẩm kỹ thuật mô, các tế bào, mô tế bào và các sản phẩm kết hợp các liệu pháp này. Ví dụ như các liệu pháp tế bào biến…
-
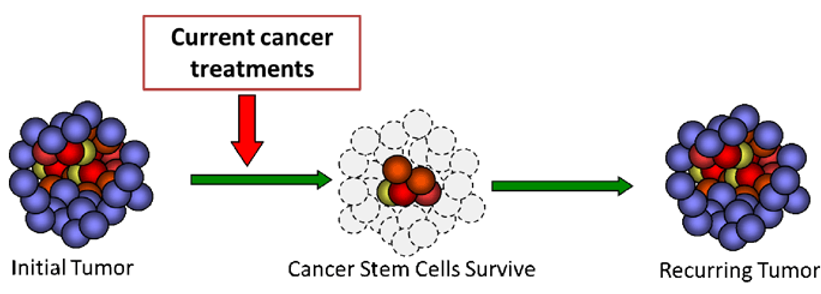
Vaccine tế bào gốc ung thư: một bước tiến mới
Các nhà nghiên cứu tại Đại học Cincinnati (UC) đã phát hiện một vắcxin tế bào gốc ung thư, được thiết kế để biểu hiện protein tiền viêm (pro-inflammatory) gọi là interleukin-15 (IL-15) và thụ thể của nó (IL-15Ralpha), gây ra sự sản sinh tế bào T trong động vật mô hình và tăng cường…
-
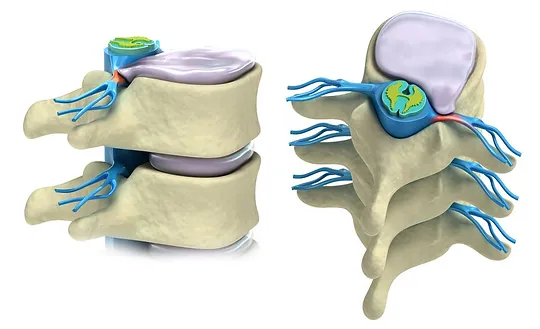
Ghép tế bào gốc tự thân có thể tái tạo sụn đĩa liên đốt sống
Đĩa sụn giữa đốt xương sống giữa vai trò quan trọng trong mỗi bước đi, uống cong và nhảy. Nếu các đĩa sụn bị thoái hoá theo thời gian, đĩa xương sống có thể bị trượt, làm chảy máu và tổn hại dây thần kinh. Hậu quả bao gồm đau dữ dội hoặc thậm chí…
-
Thiếu vitamin A sẽ làm mất dần tế bào gốc
Các nhà khoa học đã xác định được một chất chuyển hóa vitamin A gọi là acid retinoic có vai trò rất quan trọng đối với quá trình kích hoạt và bất hoạt tế bào gốc. Các nhà nghiên cứu tại Trung tâm Nghiên cứu Ung thư Đức đã phát hiện ra thiếu hụt vitamin…
-
Tế bào gốc động vật và tế bào gốc thực vật có hành vi giống nhau đến ngạc nhiên
Một nghiên cứu mới từ Đại học Lund ở Sweden cho thấy hành vi của các tế bào gốc ở thực vật và động vật là tương tự một cách đáng ngạc nhiên. Các nhà nghiên cứu đã có thể đưa ra các phương trình toán học cho thấy sự khác biệt rất nhỏ trong…
-
Bước đầu sản xuất thành công máu từ tế bào gốc
Hội Chữ thập đỏ Singapore cho biết nhu cầu về máu không bao giờ dừng lại. Người hiến tặng máu vẫn chưa đủ cho nhu cầu bệnh nhân sử dụng. Nhu cầu về máu có thể được đáp ứng, vì các nhà nghiên cứu của A*STAR, Singapore tạo ra hồng cầu từ tế bào gốc…
-
Sản xuất thành công máu từ tế bào gốc và tương lai của truyền máu
Hai nhóm nghiên cứu độc lập đã phát triển thành công tế bào hồng cầu và bạch cầu trong PTN. Điều này đã mở ra một tương lai cho máu nhân tạo được sử dụng trong truyền máu. Liệu máu sản xuất trong PTN có thể thay thế máu từ người hiến tặng. Bài viết…
-
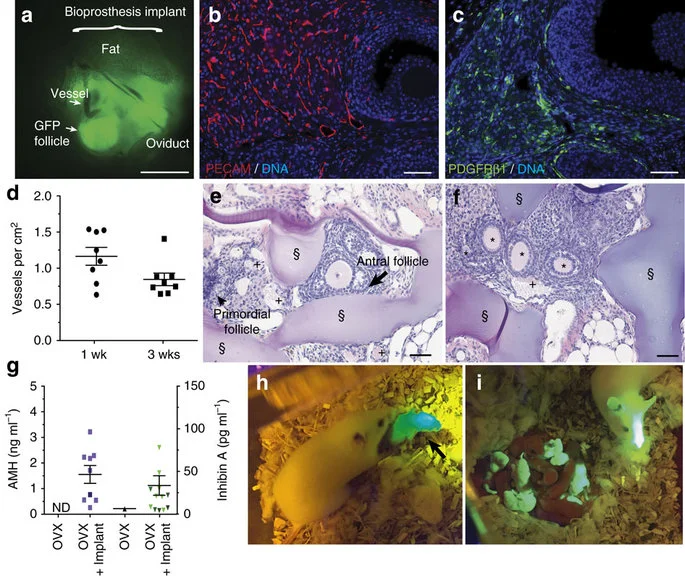
Buồng trứng được tạo ra từ công nghệ in 3D có thể phục hồi khả năng sinh sản trên chuột
Bây giờ bạn có thể in các cơ quan bằng công nghệ in 3D. Trên thực tế, các cấu trúc buồng trứng có thể được in theo cách tương tự để tạo ra một buồng trứng giống thiết kế của buồng trứng thật. Một nghiên cứu được thực hiện tại Trường Y khoa Feinberg, Trường…
-
Tinh trùng đông lạnh trong không gian có thể thụ tinh và tạo ra chuột con khỏe mạnh
Nếu NASA muốn gửi con người tới Hỏa tinh, có lẽ cũng quan trọng để đánh giá sự bất thường tinh trùng khi tồn tại trong điều kiện này. Nhưng không ai biết liệu các tế bào sinh sản có thể chịu được sự tàn phá của bức xạ gây tổn thương DNA trong không…
-
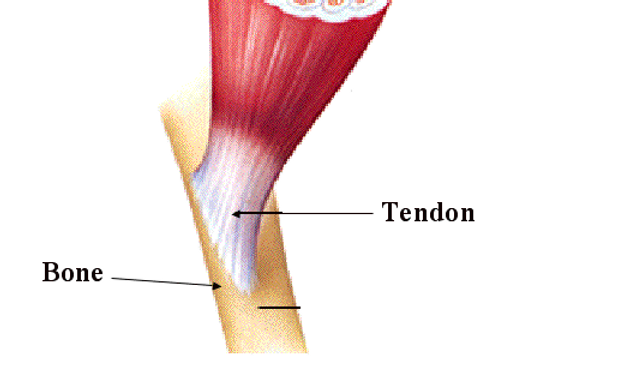
Tế bào gốc có thể làm cải thiện đáng kể tổn thương gân bằng cách điều hoà phản ứng viêm
Nghiên cứu mới đây cho thấy tiềm năng của tế bào gốc gân để cải thiện việc chữa bệnh và điều trị chấn thương gân cấp và bệnh gân mạn tính.Nghiên cứu mới được công bố trên tạp chí The FASEB Journal cho thấy tế bào gốc gân có thể cải thiện đáng kể các…