Một phát hiện đột phá gần đây đã mang lại hy vọng cho hàng triệu người sống chung với bệnh tiểu đường type 1 trên khắp thế giới. Lần đầu tiên trên thế giới, các nhà khoa học đã sử dụng liệu pháp tế bào gốc để điều trị dứt điểm bệnh tiểu đường type 1 ở một phụ nữ.
Thành tựu này được ca ngợi là một bước đột phá lớn trong y học, vì nó mang đến một phương pháp chữa trị tiềm năng cho một căn bệnh mà cho đến nay chỉ có thể kiểm soát chứ không thể chữa khỏi.
Tiểu đường type 1 là một tình trạng nghiêm trọng thường bắt đầu từ thời thơ ấu hoặc đầu tuổi trưởng thành. Trong những người mắc bệnh, hệ miễn dịch của cơ thể tấn công nhầm các tế bào trong tuyến tụy sản xuất insulin. Insulin là một hormone giúp điều chỉnh mức đường huyết. Thiếu insulin, mức đường huyết có thể tăng vọt đến mức nguy hiểm. Theo thời gian, điều này có thể dẫn tới các biến chứng sức khỏe nghiêm trọng như bệnh tim, tổn thương thần kinh, suy thận và mù lòa.
Những người mắc tiểu đường type 1 cần tiêm insulin hoặc sử dụng bơm insulin mỗi ngày để kiểm soát mức đường huyết. Dù có những điều trị này, việc quản lý bệnh vẫn có thể khó khăn và bệnh nhân thường phải đối mặt với những khó khăn suốt đời. Đó là lý do tại sao liệu pháp tế bào gốc mới này đã tạo ra nhiều sự phấn khích — nó có thể mang đến một giải pháp thực sự.
Cơ thể người trung bình bao gồm khoảng 37,2 nghìn tỷ tế bào, gấp 300 lần số lượng sao trong dải Ngân Hà của chúng ta. Tất cả các tế bào trưởng thành của chúng ta đến từ một tế bào duy nhất, được gọi là tế bào trứng thụ tinh (hoặc hợp tử), trong quá trình phát triển của chúng ta, chúng sẽ phân chia và biệt hóa thành các tế bào chuyên biệt và các tế bào gốc trưởng thành. Hợp tử là tế bào gốc ban đầu có khả năng tạo ra một người mới.
Tế bào gốc trưởng thành là các tế bào đặc biệt trong cơ thể có thể biệt hóa thành một số loại tế bào giới hạn. Các nhà khoa học đã nghiên cứu tế bào gốc trong nhiều năm và cố gắng lập trình lại các tế bào chuyên biệt thành tế bào gốc, hy vọng sử dụng chúng để điều trị các bệnh khác nhau.
Giải thích về tiểu đường type 1
Trong trường hợp của bệnh tiểu đường type 1, các nhà khoa học tự hỏi liệu tế bào gốc có thể được sử dụng để thay thế các tế bào sản xuất insulin mà cơ thể đã phá hủy hay không. Rất khó để khiến các tế bào gốc hoạt động như các tế bào sản xuất insulin cụ thể cần thiết trong tuyến tụy.
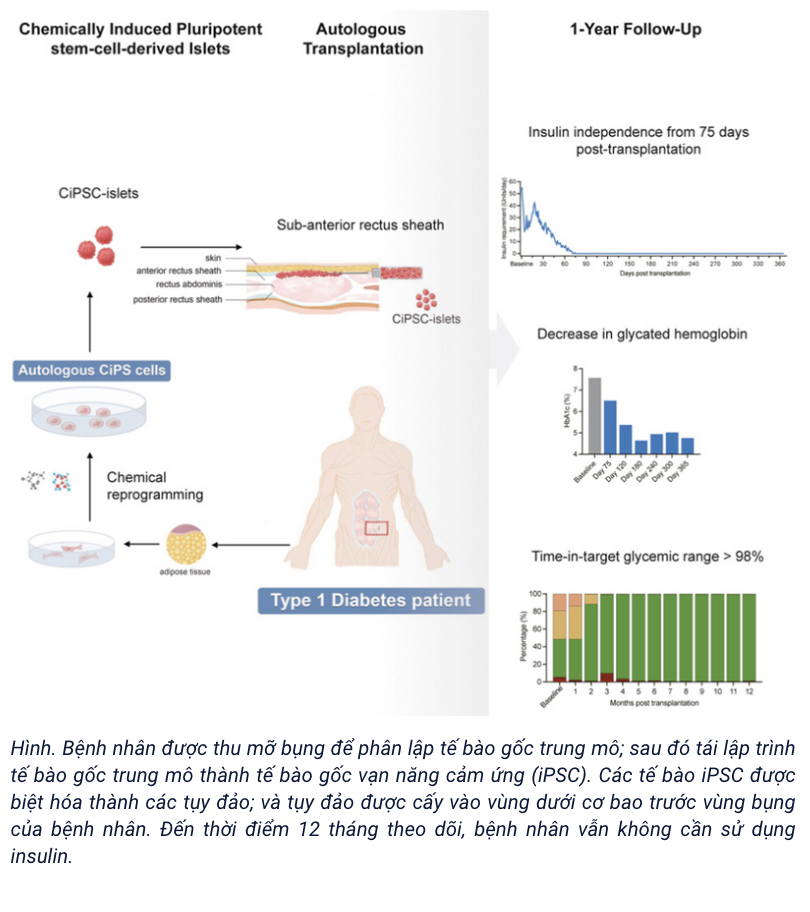
Trong một nghiên cứu gần đây, các nhà khoa học tại Đại học Bắc Kinh ở Bắc Kinh đã lấy tế bào gốc trung mô từ mô mỡ của một bệnh nhân; sau đó tái lập trình chúng thành tế bào gốc vạn năng cảm ứng bằng hóa chất; sau đó biệt hóa các tế bào gốc vạn năng này thành tụy đảo. Các tụy đảo này sau đó được cấy vào vùng bụng của cùng bệnh nhân mắc tiểu đường type 1. Điều đáng kể là các tế bào bắt đầu sản xuất insulin của riêng chúng, cho phép bệnh nhân điều chỉnh mức đường huyết sau hai tháng rưỡi mà không cần tới tiêm insulin hàng ngày.
Đó là lý do tại sao liệu pháp này được gọi là một “phương pháp chữa trị” tiềm năng cho bệnh tiểu đường type 1. Dù vẫn còn trong giai đoạn sớm, kết quả rất hứa hẹn, và liệu pháp này có thể trở nên phổ biến trong tương lai nếu các thử nghiệm lớn hơn thành công.
Những thách thức vẫn cần vượt qua
Một vấn đề là hệ miễn dịch của cơ thể, có thể tấn công các tế bào được cấy ghép mới như một phần của điều kiện tiểu đường type 1. Các nhà khoa học đang làm việc để ngăn chặn điều này và đảm bảo rằng các tế bào được cấy ghép tiếp tục hoạt động trong nhiều năm tương tự như trong giai đoạn ban đầu trong đĩa petri.
Việc làm cho liệu pháp trở nên dễ tiếp cận hơn với nhiều người sẽ là một thách thức lớn khác. Nếu được phê duyệt, các liệu pháp tế bào gốc rất đắt đỏ và phức tạp, vì vậy các nhà nghiên cứu đang tìm kiếm các phương pháp để làm cho quá trình này dễ dàng mở rộng hơn trong khi sử dụng tế bào của chính bệnh nhân để ngăn ngừa sự từ chối của tế bào được cấy ghép.
Mặc dù có những thách thức này, phát hiện gần đây đã tạo ra một làn sóng hy vọng và lạc quan cho các bệnh nhân mắc tiểu đường type 1. Liệu pháp tế bào gốc đang cho chúng ta thấy rằng có thể thực sự chữa trị các bệnh đã lâu nay được coi là chỉ có thể kiểm soát và không thể chữa khỏi.