Category: SCITech News
-
Liệu pháp gen cho phép một đứa trẻ điếc nghe được lần đầu tiên
Hầu hết chúng ta chưa bao giờ nghe về gen otoferlin (OTOF), nhưng nó đóng vai trò quan trọng trong khả năng nghe thông qua việc sản xuất một loại protein cho phép âm thanh được truyền từ tai đến não. Một số ít người trên thế giới sinh ra với đột biến di truyền,…
-
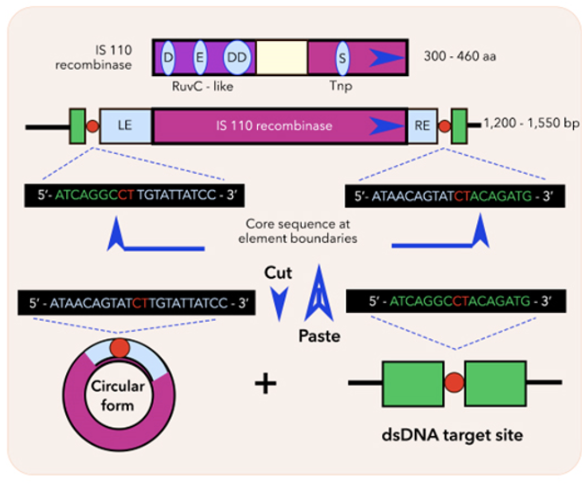
Bridge RNA đại diện cho thế hệ chỉnh sửa gen tiếp theo
Trong khi CRISPR hứa hẹn cách mạng hóa điều trị các bệnh hiếm do đột biến trong một gen duy nhất, các chuyên gia đã tiên phong khám phá lĩnh vực chỉnh sửa gen tiếp theo. Quay lại vào tháng 6, các nhà nghiên cứu tại Viện Arc, một tổ chức nghiên cứu phi lợi…
-
Công nghệ bảo quản đông lạnh tế bào gốc không dùng chất bảo quản đông lạnh
Regenmedlab giới thiệu công nghệ bảo quản đông lạnh tế bào gốc không dùng chất bảo quản lạnh Cryosave OTS.