Category: Tin tức
-
Tế bào gốc thần kinh trưởng thành nhanh hơn trong điều kiện vi trọng lực
Tế bào não duy trì sức khỏe của chúng sau một tháng trên Trạm Không gian Quốc tế nhưng trưởng thành với tốc độ nhanh hơn so với những tế bào trên Trái Đất. Vi trọng lực được biết đến với những tác động lên cơ bắp, xương, hệ miễn dịch và nhận thức; tuy…
-
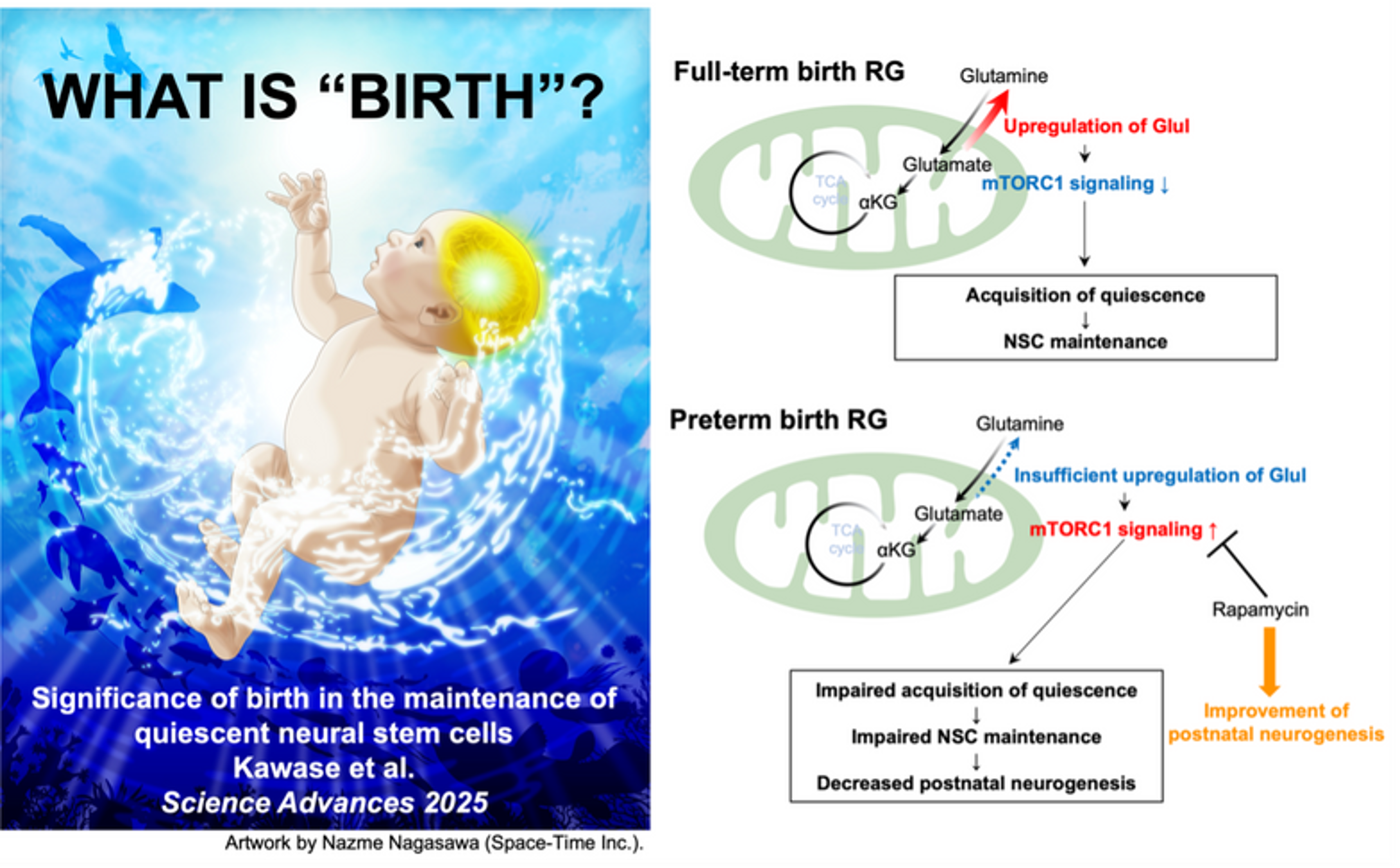
Khám phá tiết lộ tác động của sinh đẻ đến việc duy trì tế bào gốc thần kinh
Một nhóm nghiên cứu từ Đại học Thành phố Nagoya đã làm sáng tỏ tầm quan trọng của sinh đẻ trong việc duy trì tế bào gốc thần kinh (Neural stem cells – NSCs). Kết quả nghiên cứu được công bố trên tạp chí Science Advances. Sinh đẻ là một trong những sự kiện quan…
-
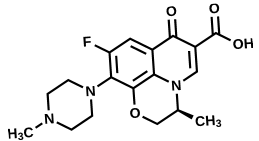
Kháng sinh levofloxacin có tác động bất lợi lên tế bào gốc tủy xương
Nghiên cứu gần đây đã đã phát hiện mới về tác động của levofloxacin, thách thức chúng ta suy nghĩ lại về tác động của loại kháng sinh này lên các tế bào gốc trung mô trong tủy xương. Những tế bào này, quan trọng cho việc sửa chữa mô, đã giảm khả năng sống…
-
OpenAI hợp tác với Retro Biosciences để thiết kế protein tế bào gốc bằng AI
OpenAI đã hợp tác với Retro Biosciences để phát triển GPT-4b micro, mô hình AI đầu tiên của hãng tập trung vào lĩnh vực sinh học, đánh dấu bước tiến mới trong việc khám phá khoa học và nghiên cứu tuổi thọ. Mô hình này đã cho thấy kết quả đầy hứa hẹn trong việc…
-
Cell BioEngines công bố thành lập cơ sở R&D mới để tiếp tục phát triển nền tảng và danh mục các liệu pháp tế bào
Ngày 21 tháng 1, 2025 (theo GLOBE NEWSWIRE), Cell BioEngines, một công ty công nghệ sinh học giai đoạn lâm sàng đang phát triển nền tảng liệu pháp tế bào gốc đồng loài “off-the-shelf” để điều trị các bệnh ung thư huyết học và khối u, công bố rằng họ đã ký hợp đồng thuê…
-
Lần đầu tiên tế bào được chỉnh sửa di truyền để giảm tính sinh miễn dịch được điều trị thử nghiệm trên người
Nền tảng hạ thấp miễn dịch (hypoimmune platform – HIP) của công ty Sana Biotechnology cho phép thực hiện một loạt các chỉnh sửa di truyền lên các tế bào, khiến các tế bào trở nên vô hình (không nhận diện) với hệ miễn dịch của bệnh nhân. Nghiên cứu đầu tiên trên người về…
-
MSCs, nhưng không phải tế bào gốc trung mô
Phạm Văn Phúc Viện Tế bào gốc, Trường Đại học Khoa học tự nhiên, ĐHQG Tp.HCM Khái niệm tế bào gốc trung mô (mesenchymal stem cell – MSC) đã trở nên quen thuộc với cộng đồng nghiên cứu và ứng dụng tế bào gốc, và khái niệm này thường được viết tắt là MSCs. Thật…
-
Thị trường và tài chính công nghiệp Tế bào gốc
2seventy bio (Massachusetts, Hoa Kỳ; www.2seventybio.com) thông báo rằng công ty, hợp tác cùng nhà tài trợ nghiên cứu Bristol Myers Squibb (New York, Hoa Kỳ; www.bms.com), sẽ ngừng tuyển dụng cho nghiên cứu KarMMa-9 giai đoạn 3 đang diễn ra. Nghiên cứu này đánh giá hiệu quả của Abecma® (idecabtagene vicleucel; ide-cel) kết hợp…
-
Thử nghiệm lâm sàng Poseida
Poseida Therapeutics (California, Hoa Kỳ; https://poseida.com/), một công ty ở giai đoạn lâm sàng về liệu pháp tế bào đồng loài và thuốc di truyền, đang phát triển các phương pháp điều trị không dùng virus cho bệnh nhân ung thư và các bệnh hiếm gặp, thông báo rằng FDA Hoa Kỳ đã cấp chỉ…
-
Thử nghiệm lâm sàng J&J
Johnson & Johnson (New Jersey, Hoa Kỳ; www.jnj.com) đã công bố kết quả dài hạn từ nghiên cứu CARTITUDE-4 giai đoạn 3, cho thấy một lần truyền duy nhất CARVYKTI® (ciltacabtagene autoleucel) đã kéo dài đáng kể thời gian sống sót (OS) ở bệnh nhân bị đa u tủy tái phát hoặc kháng lenalidomide, những…