Category: Tin tức
-
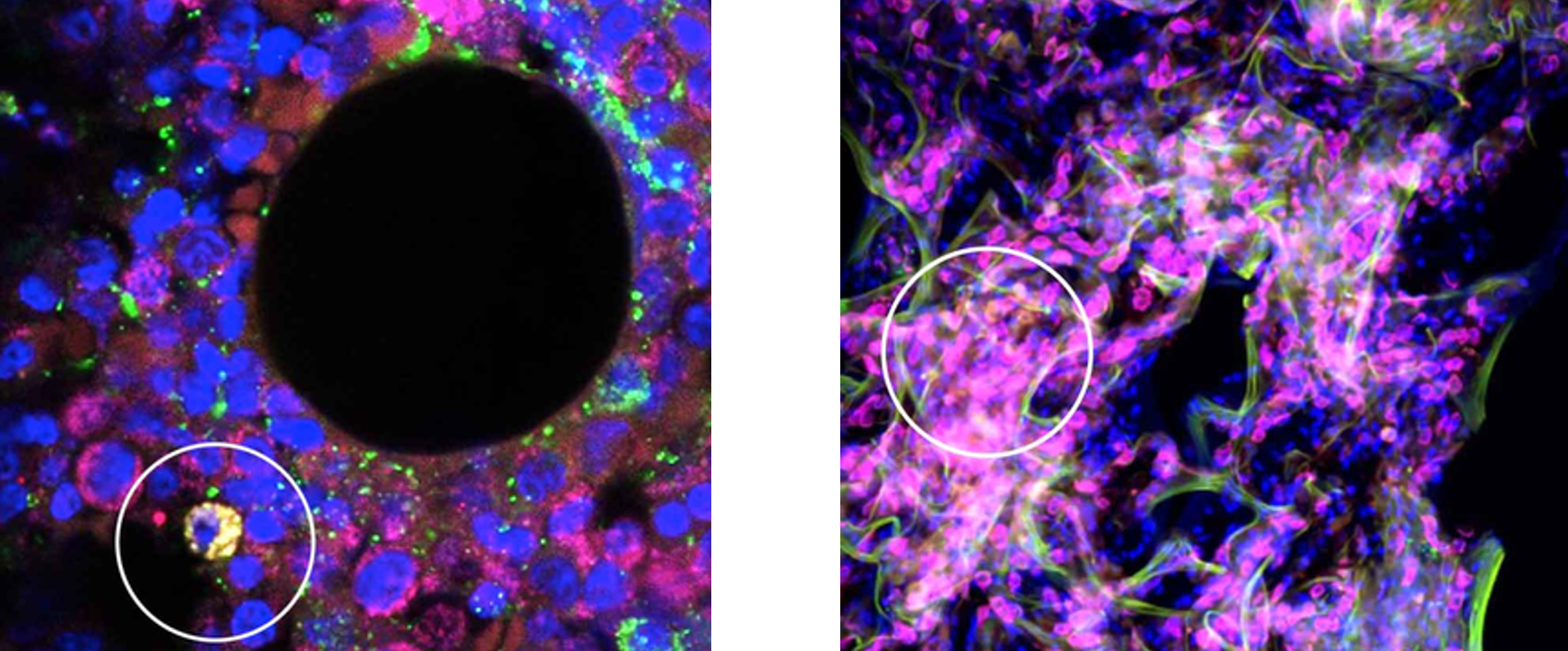
Phổi hỗ trợ tuỷ xương trong quá trình tạo máu
Mới đây, các nhà khoa học tại Đại học California, San Francisco (UCSF) đã phát hiện rằng phổi không chỉ đóng vai trò trong hô hấp mà còn tham gia vào quá trình tạo máu. Trước đây, giới khoa học tin rằng tế bào gốc tạo máu (HSCs) chỉ tồn tại trong tủy xương, nhưng…
-
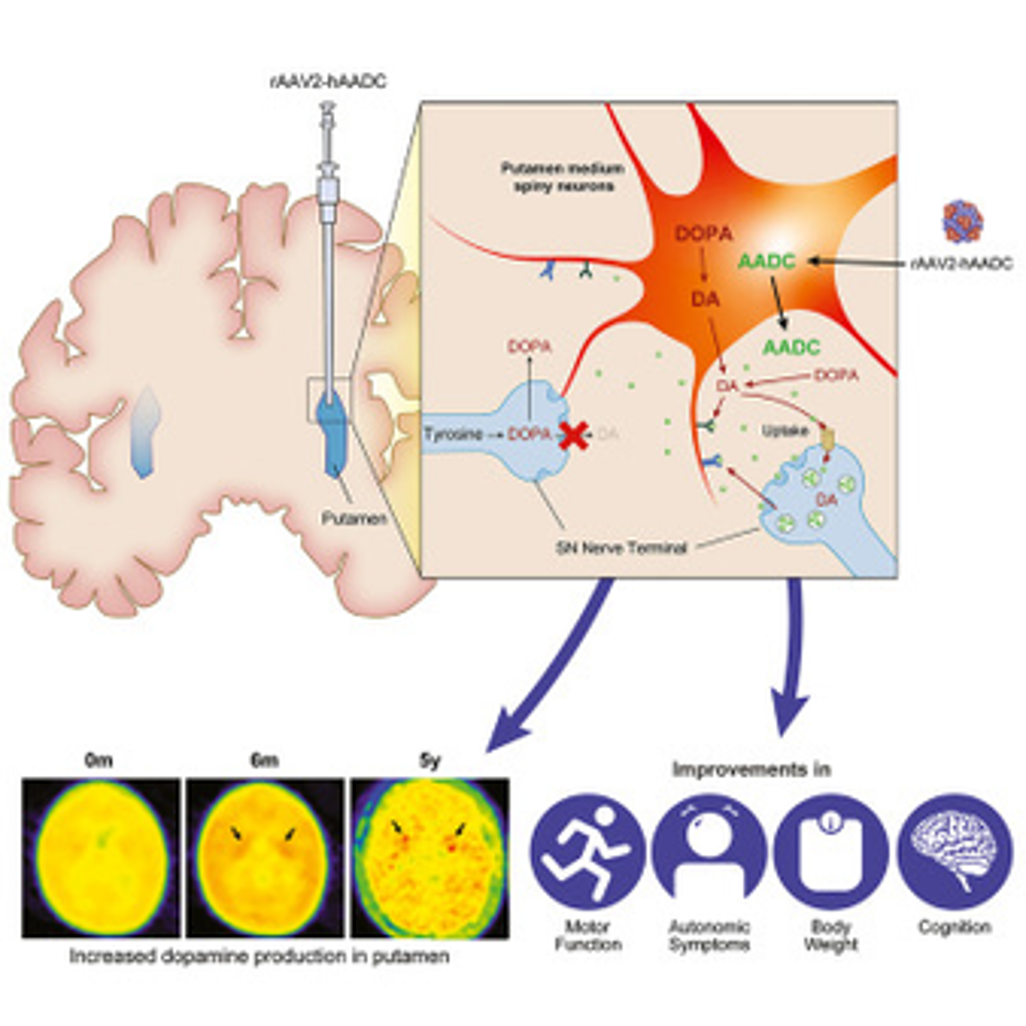
Liệu pháp AAV đầu tiên được đưa trực tiếp vào não bộ chính thức được FDA phê duyệt
Liệu pháp gen này điều trị bệnh di truyền hiếm gặp AADC bằng cách đưa một gen chức năng vào não. Cho đến gần đây, bệnh di truyền hiếm gặp thiếu hụt aromatic L-amino acid decarboxylase (AADC) vẫn chưa có cách chữa trị. Bệnh khởi phát trong những tháng đầu sau sinh, ảnh hưởng đến…
-
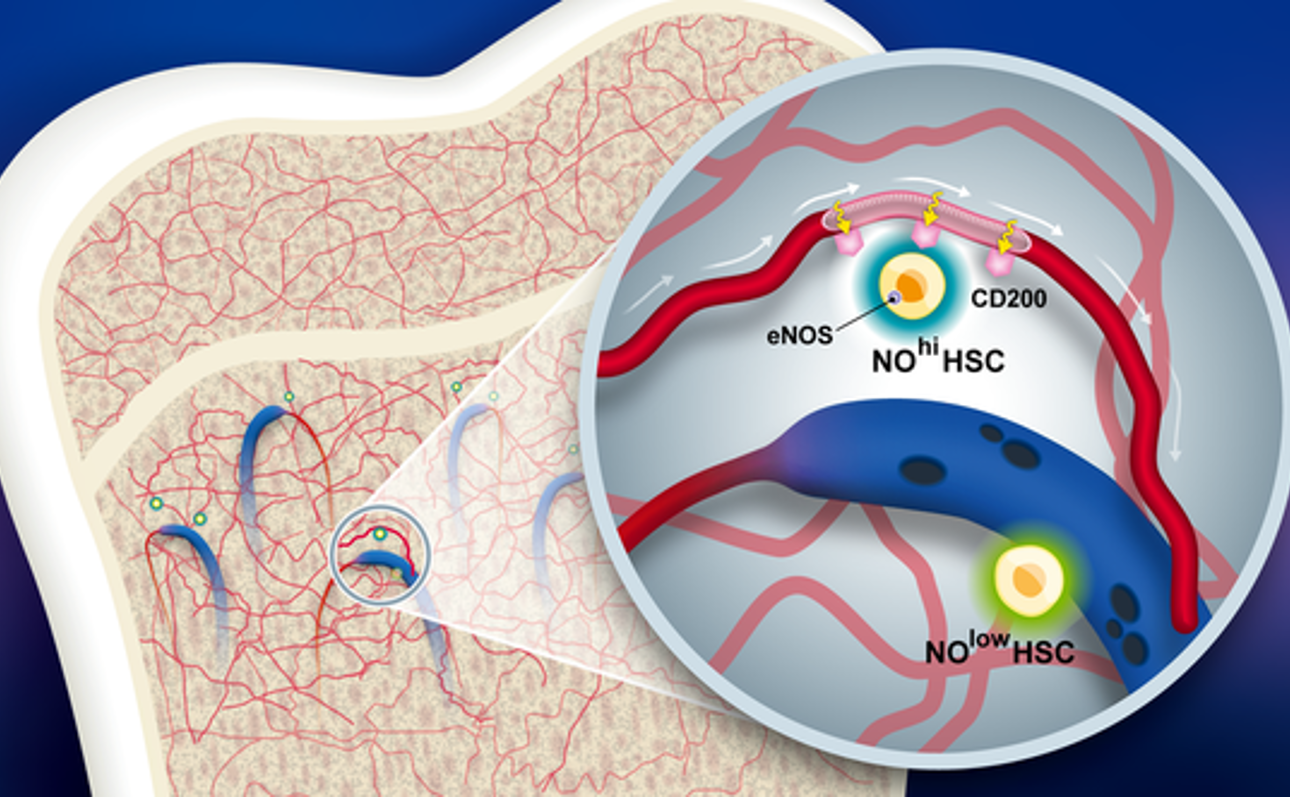
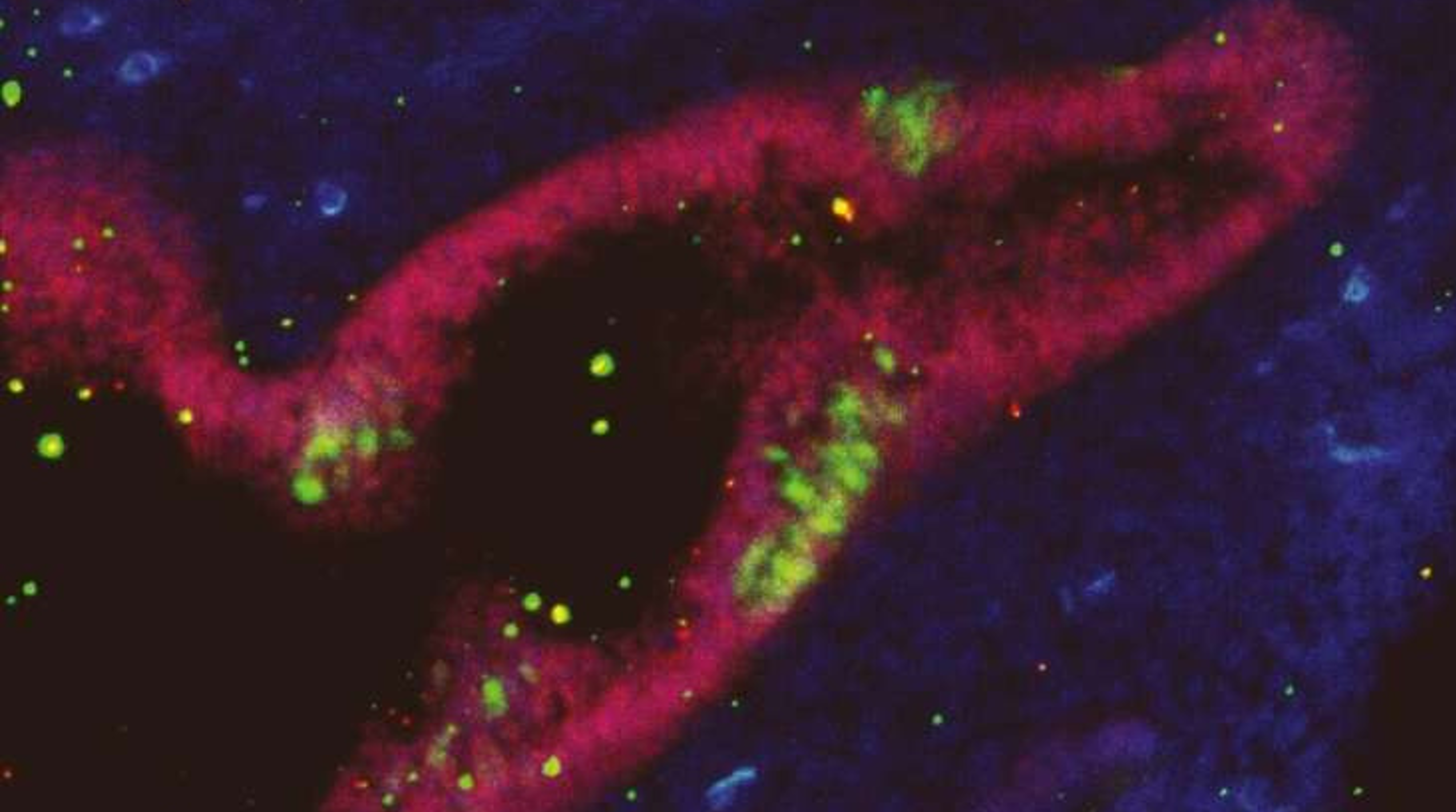
Các mạch máu chuyên biệt và nitric oxide được phát hiện là chìa khóa giúp tế bào gốc sống sót và né tránh miễn dịch
Một nhóm nghiên cứu quốc tế đã xác định được cơ chế quan trọng giúp tế bào gốc tránh bị hệ miễn dịch đào thải. Nghiên cứu của họ, công bố trên tạp chí Nature, làm sáng tỏ cách những tế bào đặc biệt này tạo ra môi trường “đặc quyền miễn dịch” – những…
-
Tế bào gốc thần kinh ngoài não: Khám phá mở ra hướng đi mới cho y học tái tạo
Trong nhiều thập kỷ, giới khoa học cho rằng tế bào gốc thần kinh (NSCs) chỉ tồn tại trong não và tủy sống. Tuy nhiên, một nghiên cứu quốc tế mới do Hans Schöler từ Viện Nghiên cứu Y sinh Phân tử Max Planck ở Münster dẫn đầu đã bác bỏ giả định này và…
-
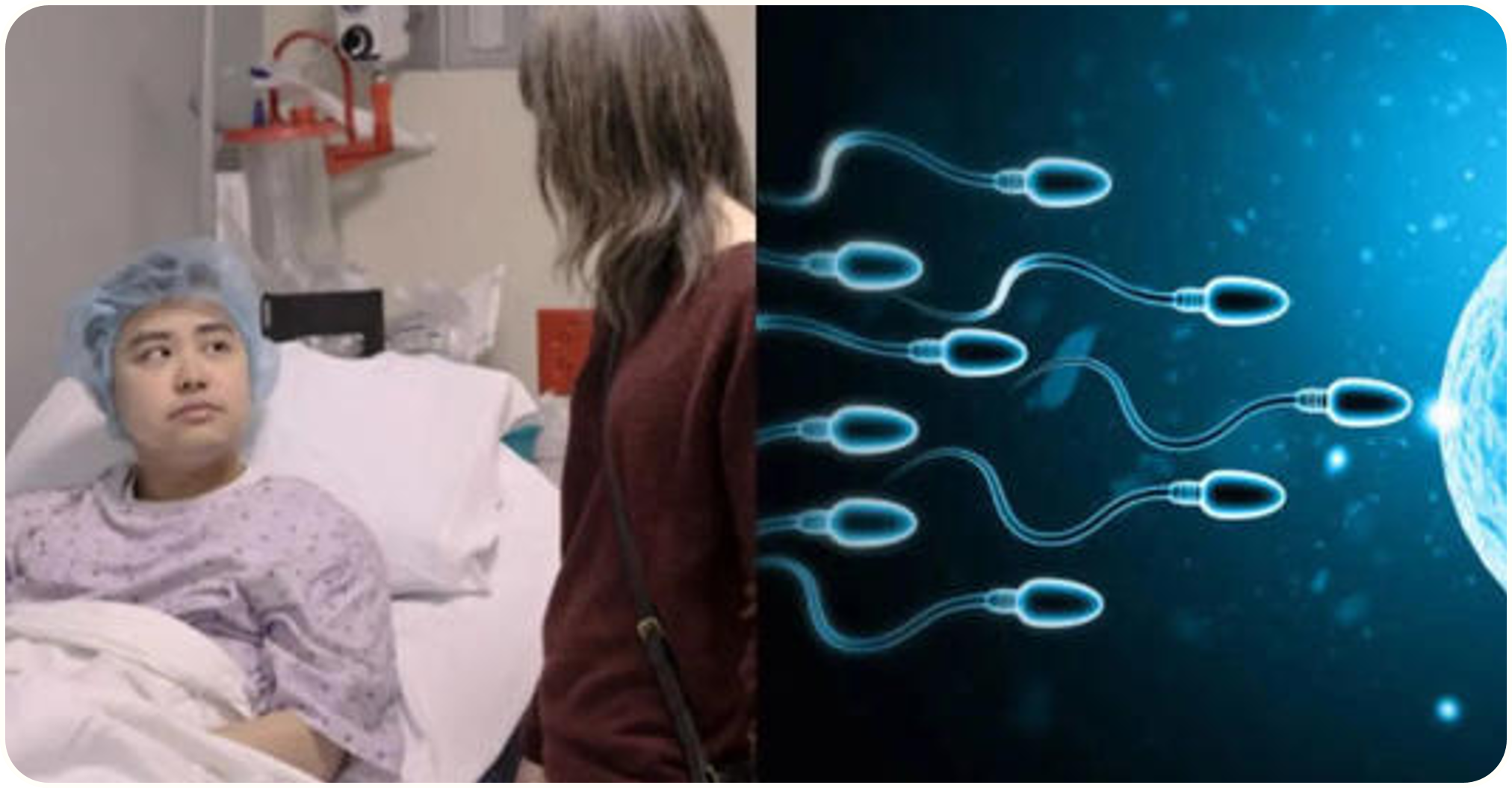
Thử nghiệm lâm sàng đầu tiên trên thế giới về liệu pháp tế bào gốc sinh tinh nhằm đảo ngược vô sinh nam
Một phương pháp điều trị đột phá có thể giúp khôi phục khả năng sinh sản ở nam giới không thể sản xuất tinh trùng, chẳng hạn như người sống sót sau ung thư hoặc những người mắc một số rối loạn di truyền. Các nhà khoa học vừa tiến hành thử nghiệm lâm sàng…
-
Nghiên Cứu Mới Xác Định Dấu Ấn Sinh Học Tiềm Năng Giúp Dự Đoán Hiệu Quả Liệu Pháp Cấy Ghép Tế Bào Gốc Trung Mô ở Bệnh Nhân Lupus Ban Đỏ Hệ Thống
Tế bào gốc trung mô (MSC) là loại tế bào gốc trưởng thành đặc biệt có khả năng ức chế miễn dịch và có thể đóng vai trò then chốt trong việc ngăn ngừa bệnh tự miễn. Trong một nghiên cứu mới, các nhà khoa học đã xác định được các dấu ấn sinh học…
-
Nhóm nghiên cứu Nhật Bản: Liệu pháp tế bào gốc giúp cải thiện chấn thương tủy sống
Một nhóm nghiên cứu tại Nhật Bản cho biết, trong một thử nghiệm lâm sàng nhằm phục hồi tổn thương tủy sống, hai trong số bốn bệnh nhân được cấy ghép tế bào gốc đặc biệt đã có dấu hiệu phục hồi chức năng vận động. Các nhà nghiên cứu từ Đại học Keio và…
-
Thêm hai người nhiễm HIV có thể được chữa khỏi sau cấy ghép tế bào gốc
Theo hai báo cáo trình bày tại Hội nghị về Retrovirus và Nhiễm trùng Cơ hội (CROI 2025) tuần này ở San Francisco, thêm hai bệnh nhân dường như đã loại bỏ được HIV sau khi cấy ghép tế bào gốc để điều trị ung thư. Nếu tình trạng thuyên giảm được duy trì, họ…
-
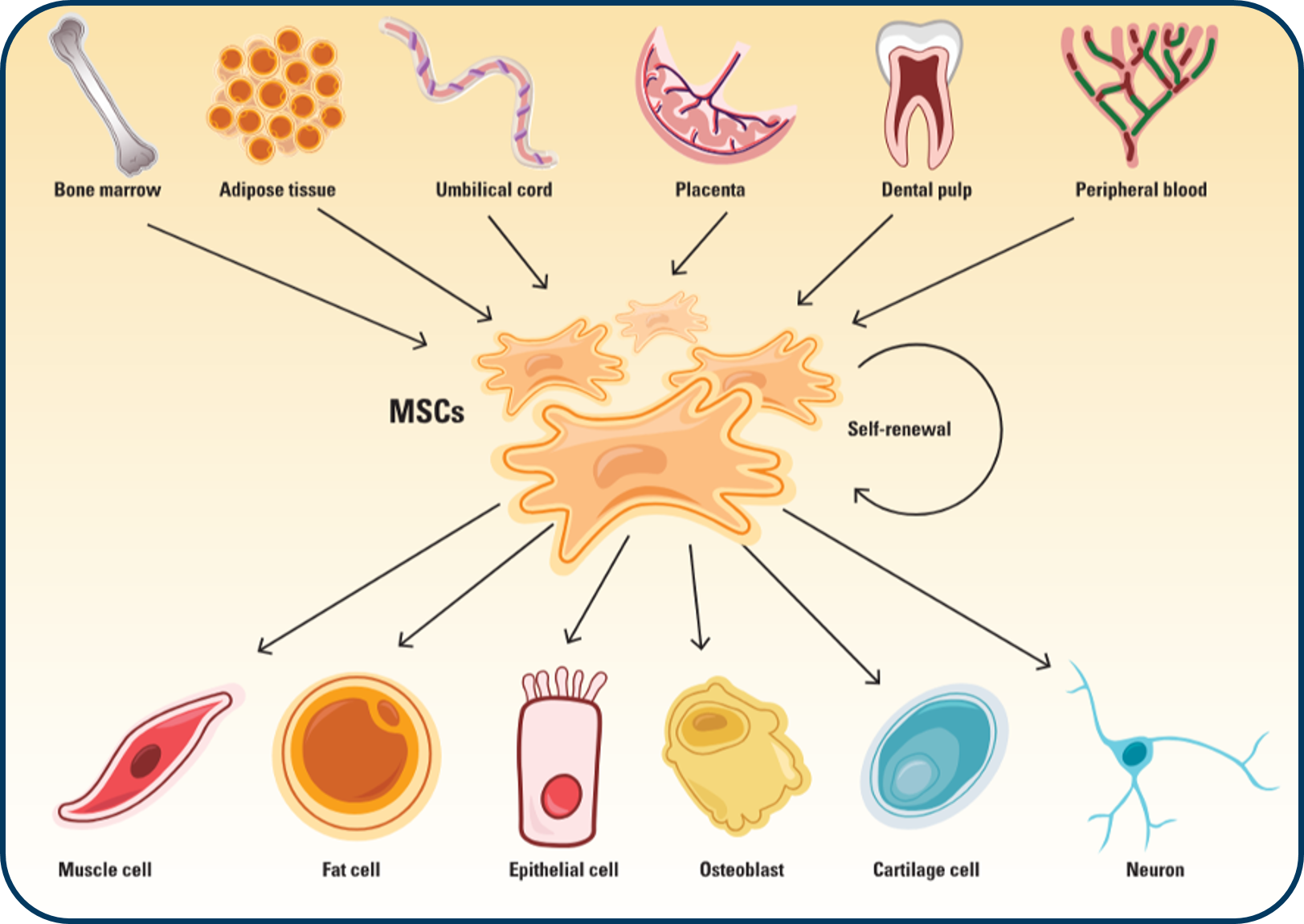
Tại sao có thể dùng tế bào gốc trung mô để điều trị bệnh?
Tại sao có thể dùngtế bào gốc trung mô để điều trị bệnh? Các tế bào gốc trung mô (MSCs) là gì? Vào những năm 1960 và 1970, Alexander Friedenstein, một nhà mô học tại Viện Hàn lâm Khoa học Y khoa Liên Xô, đã tách ra một loại tế bào mô đệm độc đáo…
-
Công ty Hoang Lam Pharmaceuticals nhập khẩu và phân phối sản phẩm thuốc tế bào gốc Stempeucel của Công ty Stempeutics Research PVT Ltd, Ấn Độ
Deramiocel (CAP-1002) bao gồm các tế bào có nguồn gốc từ cardiosphere đồng loài (CDCs), một loại tế bào đệm đã được chứng minh trong các nghiên cứu tiền lâm sàng và lâm sàng có tác dụng điều chỉnh miễn dịch, chống xơ hóa và tái tạo mạnh mẽ trong các tình trạng như loạn…