Author: admin
-
Thỏa thuận hợp tác: Viralgen và Axovia
Công ty Viralgen (Tây Ban Nha; https://viralgen.com) và Axovia Therapeutics (Vương quốc Anh; https://axoviatherapeutics.com) đã hợp tác để thúc đẩy quá trình phát triển và sản xuất liệu pháp gen thử nghiệm dựa trên vector AAV9, nhằm điều trị chứng loạn dưỡng võng mạc ở bệnh nhân mắc Hội chứng Bardet-Biedl (BBS). Hội chứng Bardet-Biedl…
-
Thỏa thuận hợp tác: Ginkgo và Universal Cells
Công ty Ginkgo Bioworks (MA, Hoa Kỳ; www.ginkgo.bio) đã công bố hợp tác nghiên cứu với Universal Cells (WA, Hoa Kỳ; https://universalcells.com), một công ty thuộc tập đoàn Astellas (Nhật Bản; www.astellas.com), nhằm tối ưu hóa các liệu pháp tế bào ung thư thế hệ mới có nguồn gốc từ tế bào gốc vạn năng…
-
Thỏa thuận cấp phép giữa Synthego và AstraZeneca
Synthego (CA, Hoa Kỳ; www.synthego.com), đơn vị cung cấp giải pháp CRISPR, đã ký kết thỏa thuận cấp phép chiến lược với AstraZeneca (Anh; www.astrazeneca.com) – tập đoàn dược sinh học toàn cầu. Thỏa thuận này cấp phép toàn cầu cho Synthego sản xuất và phân phối enzyme chỉnh sửa gen CRISPR mới của AstraZeneca…
-
Thỏa thuận hợp tác giữa Aspen Neuroscience và Mytos
Aspen Neuroscience (CA, Hoa Kỳ; www.aspenneuroscience.com) đã thúc đẩy kế hoạch tự động hóa quy trình sản xuất ANPD001 ở San Diego. ANPD001 là chương trình trị liệu tế bào thử nghiệm nhằm điều trị cho bệnh nhân Parkinson (PD), hiện đang được nghiên cứu trong thử nghiệm lâm sàng Giai đoạn 1/2a ASPIRO của…
-
Genèse Labs France Giới Thiệu Giải Pháp Chăm Sóc Da Từ Exosome – Exoluma
Ngày 20 tháng 2 năm 2025, Genèse Labs France vui mừng thông báo ra mắt Exoluma, một sản phẩm chăm sóc da ứng dụng công nghệ exosome, được thiết kế để hỗ trợ tái tạo, phục hồi và điều trị lão hóa da. Công thức kết hợp công nghệ exosome tiên tiến cùng các thành…
-
Thỏa thuận hợp tác giữa Cellipont và Secretome
Cellipont Bioservices (TX, Hoa Kỳ; www.cellipont.com) – Tổ chức Phát triển và Sản xuất Thuê ngoài (CDMO) chuyên về liệu pháp tế bào – và Secretome Therapeutics (TX, Hoa Kỳ; www.secretometherapeutics.com) – công ty công nghệ sinh học tiên phong phát triển liệu pháp từ tế bào tiền thân tim sơ sinh (nCPCs) – đã…
-
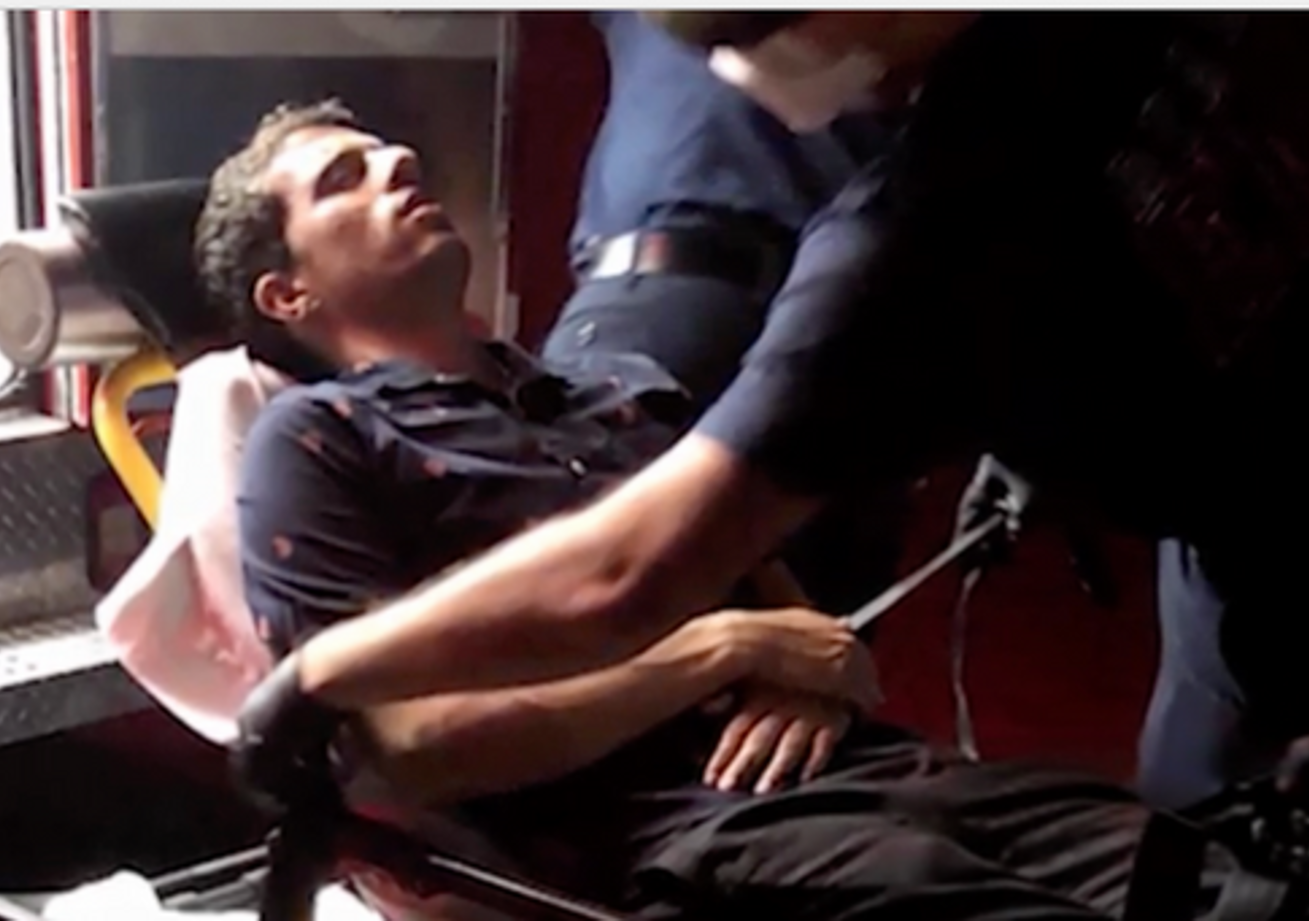
Cấy ghép tế bào gốc giúp bệnh nhân bị mù mắt trái do chấn thương phục hồi thị lực
Nick Kharufeh cho biết anh từng nghĩ mình sẽ không bao giờ nhìn thấy được bằng mắt trái nữa sau một vết thương nhiều năm trước. Giờ đây, anh đang tích cực vận động để mọi người biết đến phương pháp đã giúp anh lấy lại thị giác. Vào ngày 4 tháng 7 năm 2020,…
-
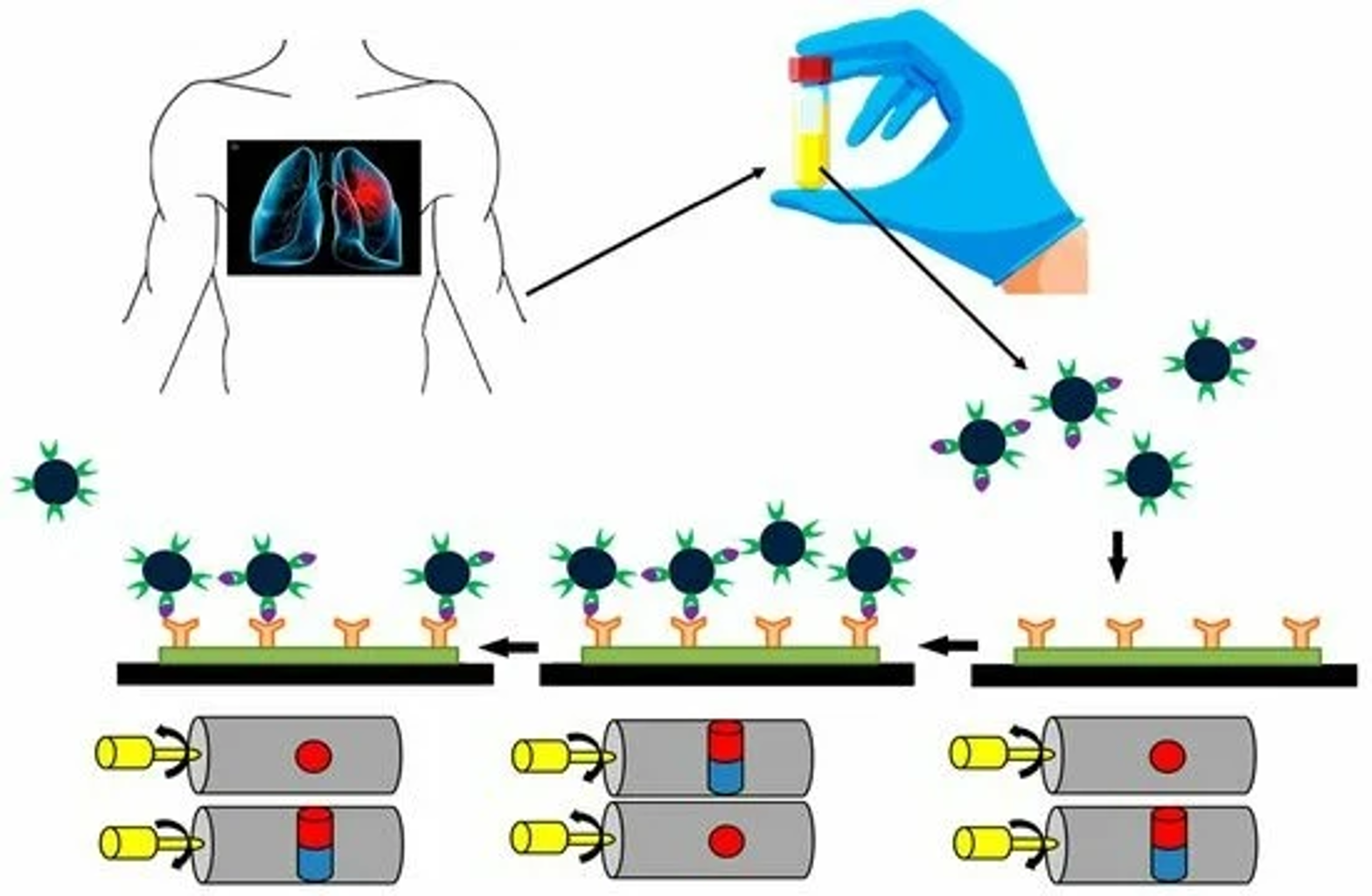
Thiết bị sàng lọc mới mở ra triển vọng phát hiện sớm ung thư phổi
Các nhà khoa học tại Đại học Cranfield đã phát triển một cảm biến chi phí thấp, có khả năng phát hiện nhanh các dấu ấn sinh học của ung thư phổi, mở ra tiềm năng ứng dụng trong các thiết bị sàng lọc nhằm phát hiện bệnh ngay cả trước khi có triệu chứng.…
-
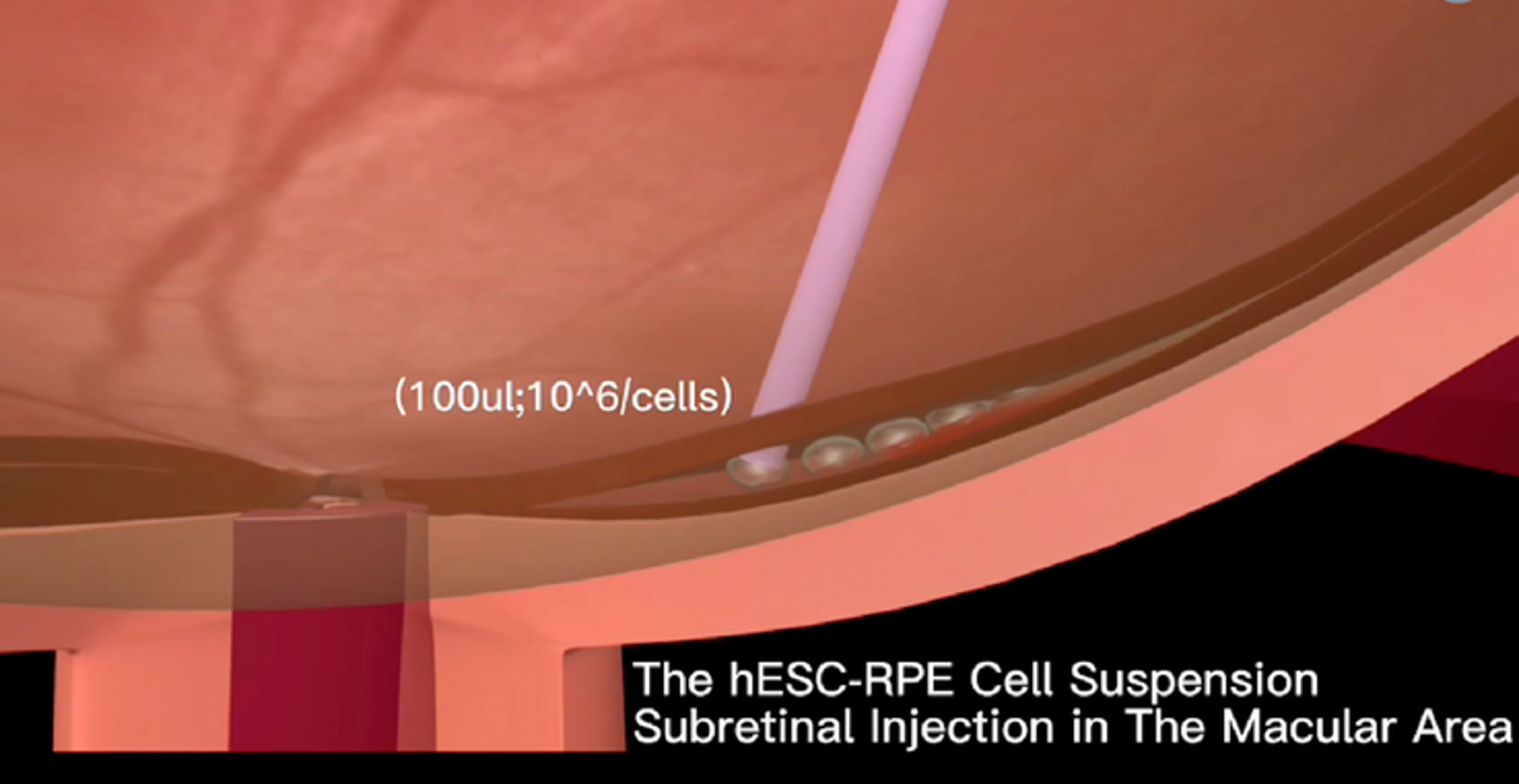
Cấy ghép tế bào gốc đạt tiêu chuẩn an toàn lâm sàng trong điều trị thoái hóa điểm vàng thể ướt
Một nghiên cứu mới đây đã cho thấy phương pháp cấy ghép tế bào gốc có thể là giải pháp thay thế hiệu quả cho những bệnh nhân mắc thoái hóa điểm vàng (AMD) thể ướt giai đoạn muộn. Công trình do nhóm nghiên cứu tại Bệnh viện Tây Nam, Đại học Quân y số…
-
Phổi hỗ trợ tuỷ xương trong quá trình tạo máu
Mới đây, các nhà khoa học tại Đại học California, San Francisco (UCSF) đã phát hiện rằng phổi không chỉ đóng vai trò trong hô hấp mà còn tham gia vào quá trình tạo máu. Trước đây, giới khoa học tin rằng tế bào gốc tạo máu (HSCs) chỉ tồn tại trong tủy xương, nhưng…