Tại sao có thể dùng
tế bào gốc trung mô để điều trị bệnh?
Các tế bào gốc trung mô (MSCs) là gì?
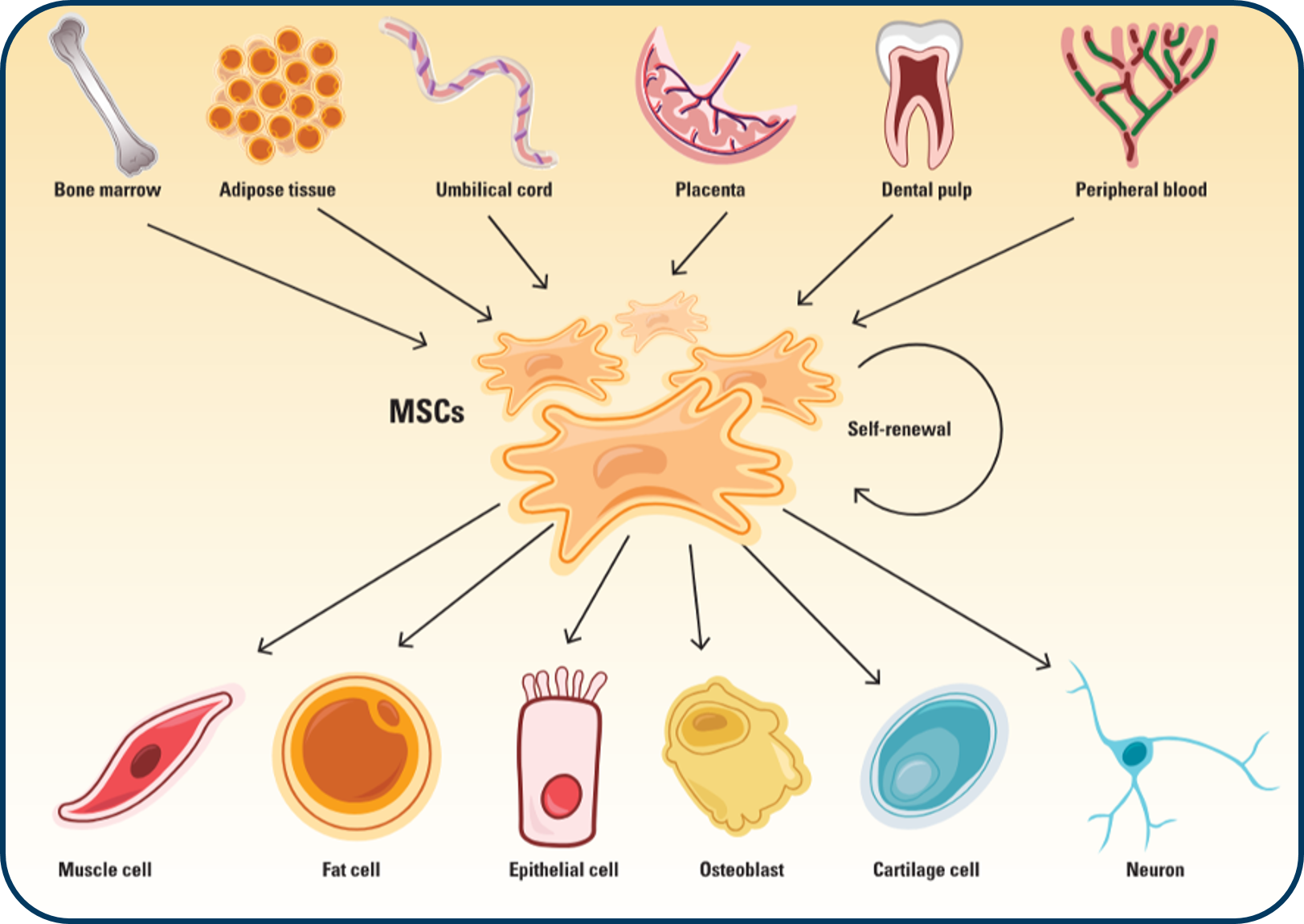
Vào những năm 1960 và 1970, Alexander Friedenstein, một nhà mô học tại Viện Hàn lâm Khoa học Y khoa Liên Xô, đã tách ra một loại tế bào mô đệm độc đáo từ tủy xương của chuột. Khi nuôi cấy in vitro và cấy ghép vào động vật, những tế bào có hình thoi này đã biệt hóa thành tế bào xương, sụn, và mỡ. Quan sát này đã dẫn đến phát hiện về các MSCs. Sau đó, các nhà khoa học nhận thấy rằng trong khi MSCs chủ yếu có mặt trong tủy xương, chúng cũng tồn tại ở các mô khác như mỡ, dây rốn, máu ngoại vi, và tủy răng.
Khác với các tế bào gốc phôi, có thể phát triển thành bất kỳ loại tế bào nào trong cơ thể, MSCs là đa tiềm năng. Điều này có nghĩa là chúng có thể biệt hóa thành một số loại tế bào chọn lọc, bao gồm tế bào biểu mô, tế bào cơ, nơron, và các mô liên kết như xương, sụn, và mỡ. MSCs có khả năng tự tái tạo, cho phép chúng sao chép và duy trì quần thể của mình trong thời gian dài và hỗ trợ tái tạo mô liên tục.
Ngoài khả năng tự làm mới và biệt hóa, MSCs đóng vai trò quan trọng trong việc điều chỉnh các phản ứng miễn dịch, đặc biệt là trong các môi trường viêm nhiễm như nhiễm trùng hoặc vết thương. Chẳng hạn, khi viêm nhiễm xảy ra, MSCs di chuyển đến các mô bị ảnh hưởng, nơi chúng hỗ trợ sửa chữa mô bằng cách giải phóng các cytokine và chất trung gian cụ thể làm ức chế hoạt động của tế bào T thực thi (effector T cells) và kích hoạt các tế bào T điều hòa ức chế miễn dịch, khôi phục lại cân bằng miễn dịch. Ngoài ra, MSCs thể hiện các đặc tính chống xơ hóa bằng cách tái tạo lại chất nền ngoại bào và giảm hoạt động của nguyên bào cơ. Chúng cũng tiết ra các yếu tố tăng sinh mạch thúc đẩy sự hình thành mạch máu mới.
Các tiềm năng trị liệu mà MSCs mang lại là gì?
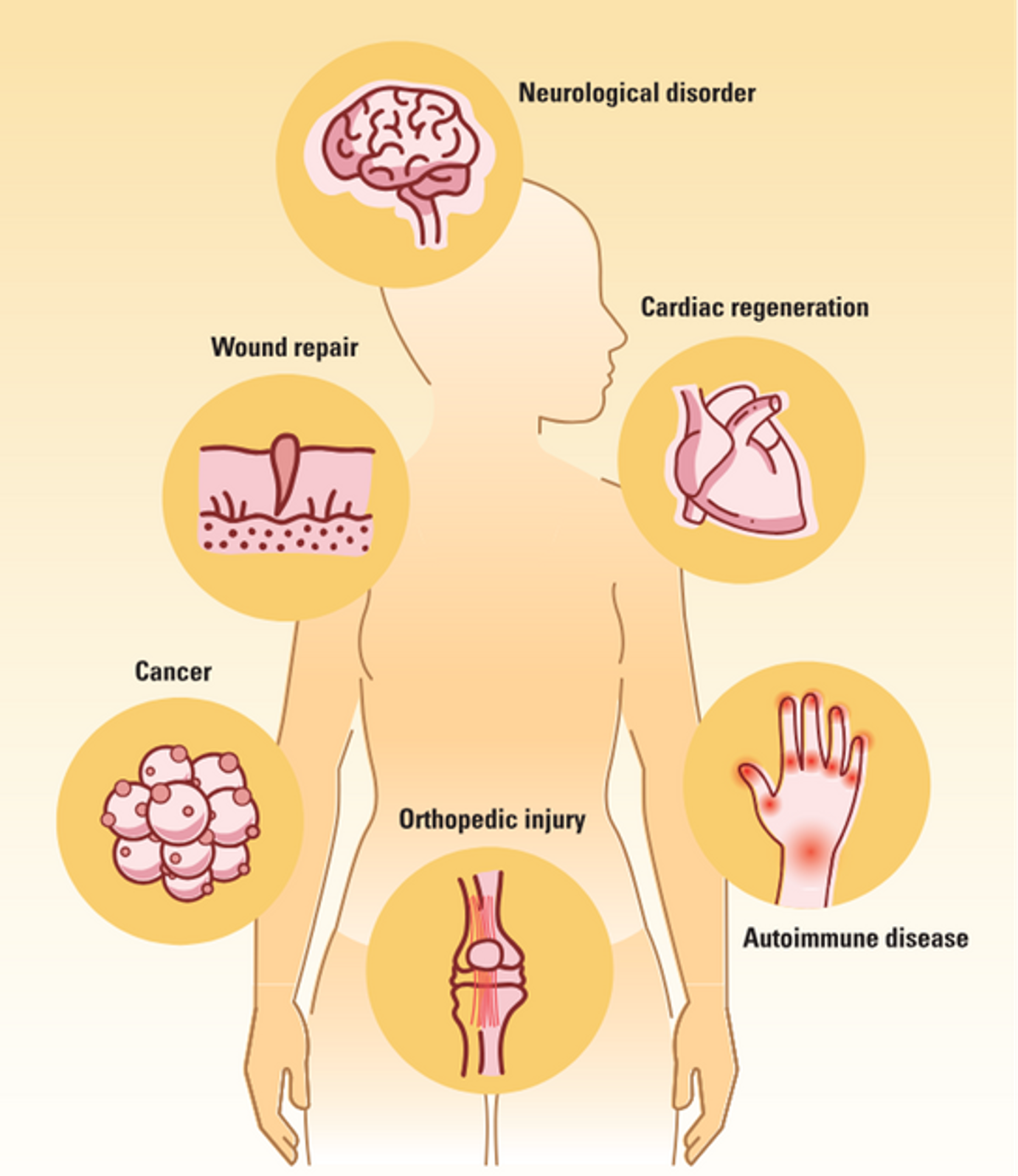
MSCs có thể được phân lập từ nhiều nguồn khác nhau, có khả năng biệt hóa thành các loại tế bào đa dạng, cùng với đặc tính miễn dịch đặc biệt trở thành một công cụ trị liệu hấp dẫn. Các cơ quan quản lý trên toàn thế giới đã phê duyệt mười hai liệu pháp dựa trên MSCs, và hơn 1.000 thử nghiệm lâm sàng đã được thực hiện hoặc đang tiến hành để khám phá tiềm năng của chúng trong việc điều trị một loạt các bệnh (4).
Trong tái tạo xương, MSCs là một lựa chọn đầy hứa hẹn so với ghép xương tự thân truyền thống, vốn có những hạn chế như khả năng sáp nhập, thời gian phục hồi kéo dài và đau đớn tại vị trí lấy mảnh. Các nghiên cứu lâm sàng đã chỉ ra rằng MSCs có nguồn gốc từ tủy xương và dây rốn có thể cải thiện việc lành gãy xương và giảm đau trong viêm xương khớp (5,6). Trong điều trị lành vết thương, MSCs đã cho thấy hiệu quả trong việc tăng cường tái tạo mô và giảm sẹo bằng cách thúc đẩy sự phát triển của nguyên bào sợi và tế bào nội mô. Một số thử nghiệm lâm sàng đã báo cáo kết quả thành công trong việc chữa lành vết thương mãn tính, loét và sẹo dây thanh âm với rất ít các tác dụng phụ nghiêm trọng (7,8).
Trong khi đó, các nhà khoa học đang nghiên cứu vai trò của MSCs trong việc điều trị các rối loạn thần kinh như xơ cứng teo cơ một bên, bệnh Parkinson và đột quỵ (9–11). Trong các bệnh này, MSCs có thể giúp sửa chữa tế bào thần kinh vận động bị hư hại và cải thiện khả năng phục hồi chức năng. Việc điều trị bệnh tim mạch cũng được hưởng lợi từ các liệu pháp MSCs, với các nghiên cứu chỉ ra rằng việc cấy ghép MSCs cho bệnh nhân bị nhồi máu cơ tim làm tăng khả năng sống còn của cơ tim và lưu lượng máu tim (12). Ngoài ra, MSCs đã được thử nghiệm trong điều trị các bệnh tự miễn, như viêm khớp dạng thấp và tiểu đường loại 1 nhờ khả năng điều chỉnh các phản ứng miễn dịch hoạt động quá mức, và ung thư khi được biến đổi gen nhắm mục tiêu các khối u hay có khả năng vận chuyển các tác nhân chống khối u (13,14).
Làm thế nào để các nhà khoa học tạo ra liệu pháp MSC?
Bước đầu tiên trong việc tạo ra liệu pháp MSCs là tách chiết các tế bào này từ các nguồn phổ biến như tủy xương, mô mỡ, dây rốn và máu dây rốn. MSCs có thể là tự thân, thu được từ mô của chính bệnh nhân, hoặc đồng loài – lấy từ người hiến khỏe mạnh. Để tách MSCs từ các mẫu mô đã thu thập, các nhà khoa học sử dụng các phương pháp cơ học và enzym để tách chúng ra khỏi các tế bào khác.
Sau khi được tách, các nhà khoa học tiến hành nuôi cấy MSCs in vitro để tạo ra số lượng tế bào đủ cho các ứng dụng điều trị. Các tế bào được tách từ mô người hiến thường cần được nuôi cấy để đạt đến số lượng từ một đến chín tỷ tế bào cho điều trị trên người trưởng thành. Trong môi trường nghiên cứu, các nhà khoa học thường tiến hành các thí nghiệm quy mô nhỏ sử dụng kỹ thuật nuôi cấy tế bào truyền thống để thử nghiệm các điều kiện phát triển khác nhau.
Khi sản phẩm chuyển sang giai đoạn sản xuất thương mại, họ thường sử dụng các bioreactor để tăng sinh quy mô lớn. Các bioreactor này tạo ra một môi trường kiểm soát, tối ưu hóa sự phát triển của MSCs bằng cách quản lý các thông số quan trọng như nhiệt độ, pH, và mức độ dinh dưỡng, duy trì tính toàn vẹn của MSCs trong suốt quá trình tăng sinh
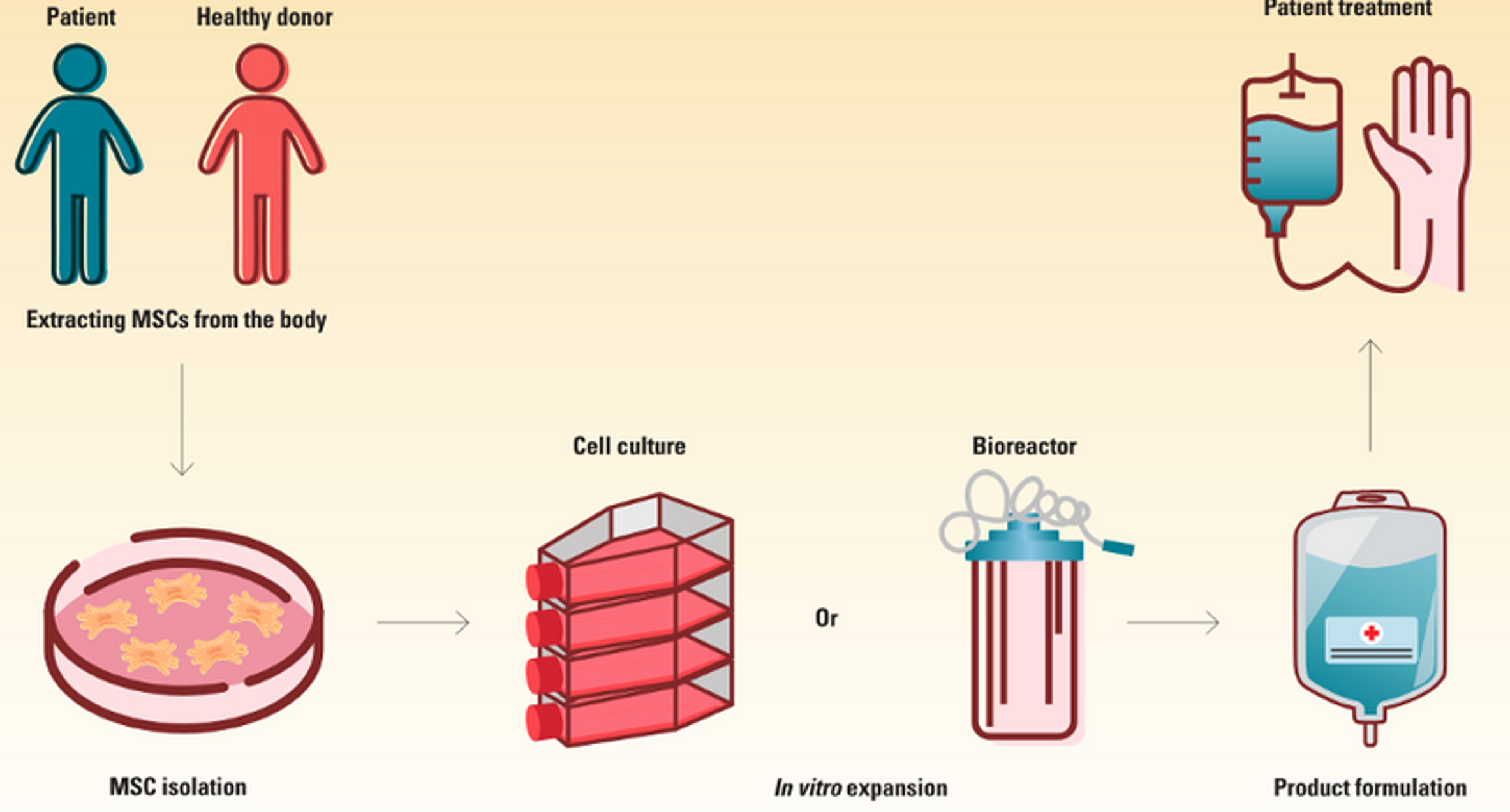
Sau khi đạt đủ số lượng tế bào mong muốn, các nhà khoa học tiến hành thu hoạch và phân tích kỹ lưỡng các đặc điểm về định danh, khả năng và tính an toàn của chúng, trong đó có việc kiểm tra các dấu hiệu bề mặt, tiềm năng biệt hóa, và các yếu tố được tiết ra góp phần vào hiệu quả điều trị của chúng. Sau khi có đủ số lượng MSCs đạt chất lượng, các nhà nghiên cứu có thể khảo sát các ứng dụng điều trị của chúng. Trong các môi trường lâm sàng, bệnh nhân có thể nhận liệu pháp MSCs thông qua tiêm tĩnh mạch hoặc tiêm trực tiếp vào mô mục tiêu.
Làm thế nào MSCs phát huy tác dụng điều trị trong cơ thể?
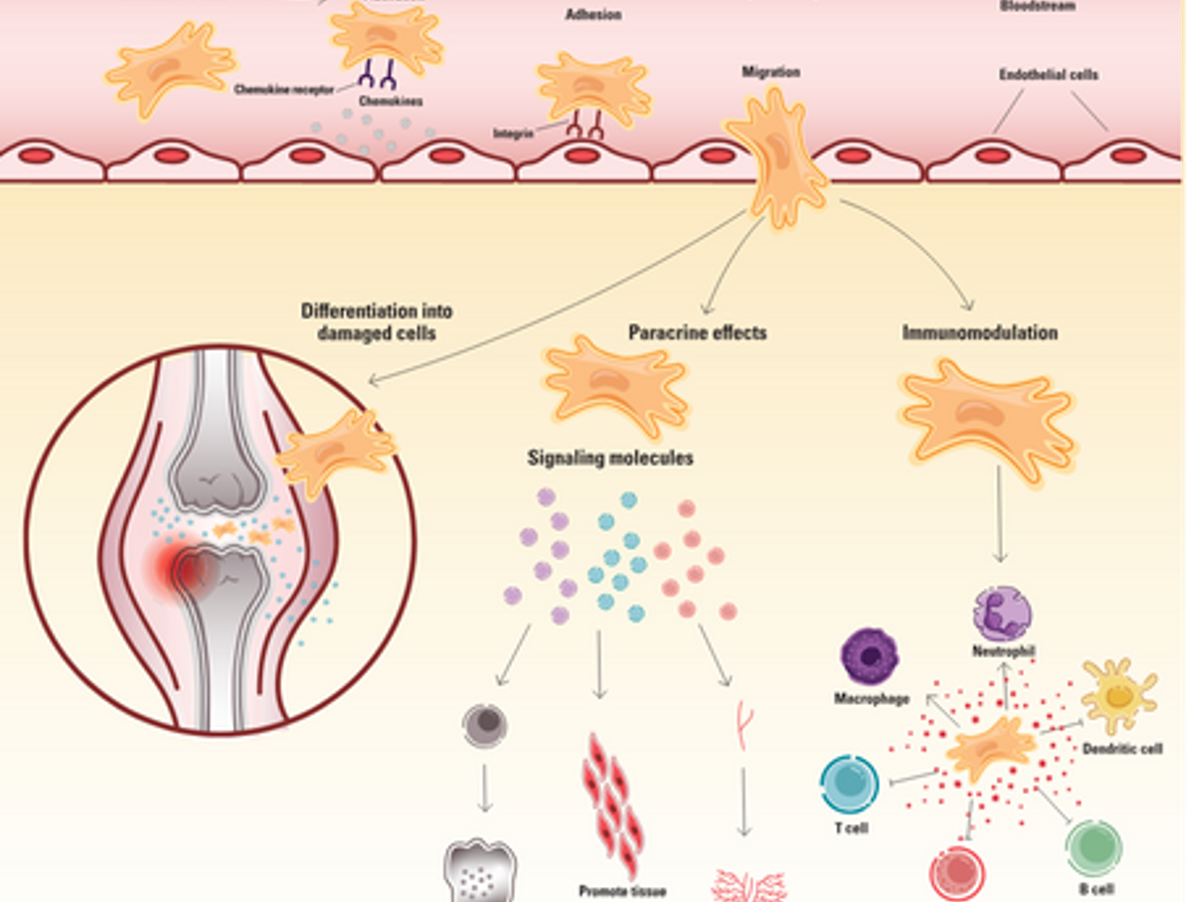
Sau khi được đưa vào cơ thể, MSCs di chuyển qua máu và phản ứng với các tín hiệu viêm như chemokine do mô bị tổn thương giải phóng. Những chemokine này tạo ra một gradient định hướng MSCs đến vị trí tổn thương và thúc đẩy các tế bào nội mô lót các mạch máu biểu hiện các phân tử bám dính trên bề mặt. Khi MSCs di chuyển trong hệ tuần hoàn, chúng lăn dọc theo bề mặt nội mô và bám vào những phân tử bám dính này thông qua các thụ thể bề mặt như integrin. Khi đã bám chắc, MSCs đi xuyên qua hàng rào nội mô và tiếp tục di chuyển theo các tín hiệu hóa học để đến vị trí bị tổn thương. Khi đến nơi, MSCs thích nghi với vi môi trường tại đó và biệt hóa thành các loại tế bào cần thiết để sửa chữa tổn thương.
Ngoài việc trực tiếp biệt hoá thành các loại tế bào chuyên biệt, MSCs còn đóng vai trò điều trị thông qua việc tiết ra một loạt các phân tử có hoạt tính sinh học như cytokine, yếu tố tăng trưởng và các túi ngoại bào chứa RNA thông tin, microRNA và peptide. Những yếu tố cận tiết này điều chỉnh vi môi trường địa phương, thúc đẩy sự sống sót của tế bào, sự tăng sinh và tái tạo mô.
Ví dụ, MSCs giải phóng yếu tố tăng trưởng nội mô mạch máu (VEGF), giúp tạo mạch, hình thành các mạch máu mới cần thiết để cung cấp chất dinh dưỡng và oxy cho các mô bị tổn thương. Chúng cũng tiết ra các yếu tố ức chế sự chết tế bào như yếu tố tăng trưởng tế bào gan, interleukin-6 (IL-6) và miRNA-25 để tăng cường sự sống sót của tế bào, và các yếu tố chống xơ hóa như prostaglandin E2 (PGE2) và IL-10, giúp giảm sẹo xơ hóa.
Một cơ chế quan trọng khác mà MSCs phát huy tác dụng điều trị là điều hòa miễn dịch thông qua sự kết hợp giữa các yếu tố được tiết ra và sự tương tác trực tiếp giữa các tế bào. Chúng tiết ra các phân tử chống viêm như yếu tố tăng trưởng chuyển dạng beta (TGFβ), PGE2, IL-10, và indoleamine 2,3-dioxygenase (IDO), ức chế hoạt động của các tế bào T, B, tế bào đuôi gai và tế bào tiêu diệt tự nhiên (NK).
MSCs cũng ảnh hưởng đến hệ miễn dịch thông qua tiếp xúc trực tiếp bằng cách biểu hiện các phân tử bề mặt như ligand-1 của thụ thể chết được lập trình, gây ra sự chết tế bào T thông qua quá trình apoptosis và thúc đẩy sự phát triển của tế bào T điều hòa. Ngoài ra, MSCs có thể chuyển đổi macrophage từ trạng thái gây viêm sang trạng thái chống viêm. Bằng cách giới hạn sự viêm, MSCs tạo ra môi trường ức chế miễn dịch để mô lành và tái tạo.
Làm thế nào MSCs phát huy tác dụng điều trị trong cơ thể?
Mặc dù nhiều nghiên cứu và thử nghiệm lâm sàng đã báo cáo rằng liệu pháp MSCs là an toàn với các tác dụng phụ tối thiểu, nhưng khả năng sinh khối u vẫn là một mối quan tâm đáng kể. Điều này là do MSCs chia sẻ một số đặc điểm với tế bào khối u, chẳng hạn như khả năng tăng sinh trong thời gian dài và khả năng chống lại quá trình chết tế bào theo chương trình (apoptosis) cao. Một số yếu tố, bao gồm tuổi của người hiến tặng và trạng thái miễn dịch của người nhận, có thể ảnh hưởng đến nguy cơ sinh khối u sau khi cấy ghép MSCs. Việc thao tác và nuôi cấy MSCs kéo dài cũng có thể dẫn đến bất ổn di truyền, tăng khả năng biến đổi ác tính.
Các nghiên cứu trên động vật đã cung cấp bằng chứng cho thấy MSCs có thể thúc đẩy sự phát triển của khối u trong các mô hình ung thư khác nhau, làm nổi bật sự tương tác phức tạp giữa MSCs và sinh học khối u. Ví dụ, nghiên cứu đã chỉ ra rằng các tế bào ung thư vú di căn có thể kích thích MSCs tiết chemokine C-C motif ligand 5 (CCL5), tạo điều kiện cho sự xâm nhập của khối u. Các nghiên cứu khác đã tiết lộ rằng các yếu tố tăng trưởng, chẳng hạn như VEGF và yếu tố tăng trưởng nguyên bào sợi cơ bản (bFGF) do MSCs tiết ra có thể ức chế quá trình apoptosis của tế bào khối u.
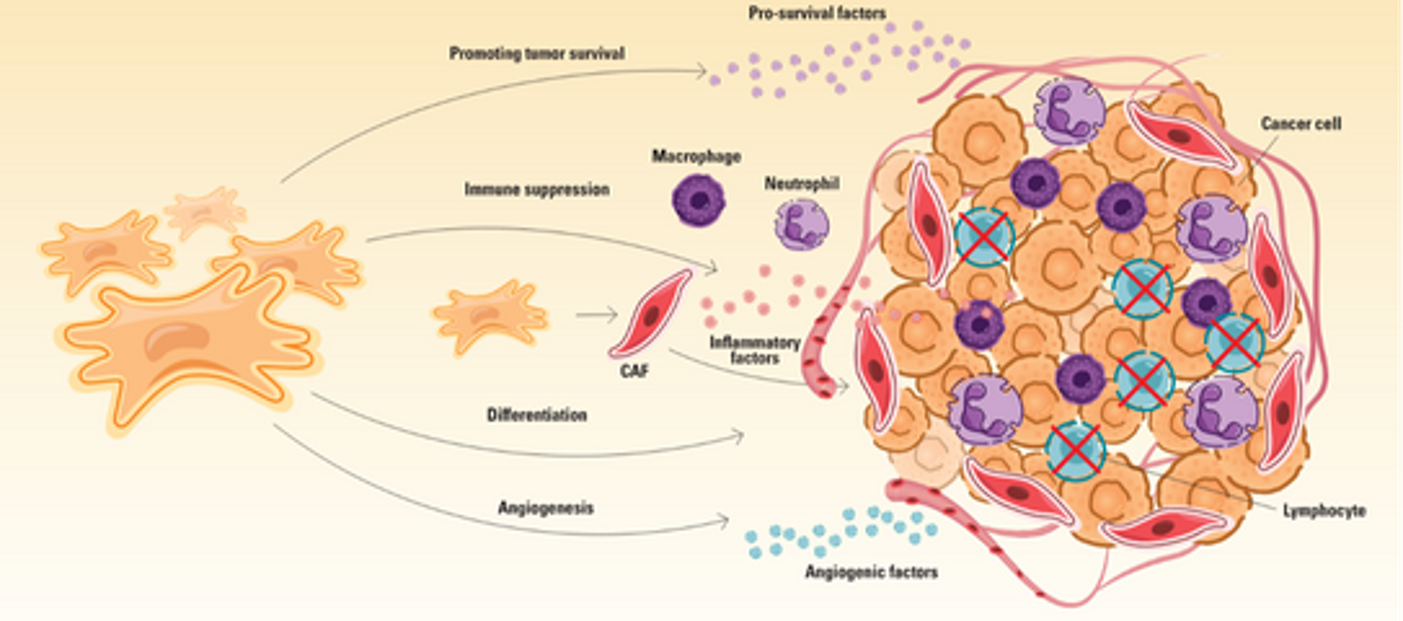
MSCs cũng đóng góp vào sự tiến triển của ung thư bằng cách giải phóng các yếu tố gây viêm làm suy giảm miễn dịch trong môi trường vi mô của khối u. Ví dụ, MSCs được tách ra từ các khối u dạ dày tiết IL-8, một chemokine gây viêm thúc đẩy sự huy động của đại thực bào và bạch cầu trung tính đến vị trí khối u, tạo điều kiện cho sự khởi đầu và tiến triển của ung thư. Ngoài ra, MSCs tiết ra TGFβ, thúc đẩy sự xâm nhập của đại thực bào và hỗ trợ khối u tránh né hệ miễn dịch.
Hơn nữa, MSCs hỗ trợ tạo mạch máu cho khối u, một quá trình cung cấp dưỡng chất và oxy quan trọng cho khối u bằng cách biểu lộ các yếu tố tạo mạch như TGFβ, VEGF và IL-6. Đáp ứng lại với các yếu tố hòa tan do tế bào ung thư tiết ra, đặc biệt là TGFβ, MSCs có thể biệt hóa thành nguyên bào sợi liên quan đến ung thư (CAFs), một loại tế bào trong môi trường vi mô của khối u có khả năng thúc đẩy tăng sinh khối u. Với những rủi ro tiềm tàng liên quan đến ung thư, việc thực hiện các nghiên cứu để hiểu đầy đủ các tác động của liệu pháp MSCs trong điều trị bệnh đóng vai trò cực kì quan trọng.
TÀI LIỆU THAM KHẢO
- Friedenstein, A. J., Chailakhyan, R. K., Latsinik, N. V., Panasyuk, A. F. & Keiliss-Borok, I. V. STROMAL CELLS RESPONSIBLE FOR TRANSFERRING THE MICROENVIRONMENT OF THE HEMOPOIETIC TISSUES: Cloning In Vitro and Retransplantation In Vivo. Transplantation 17, 331 (1974).
- Uccelli, A., Moretta, L. & Pistoia, V. Mesenchymal stem cells in health and disease. Nat Rev Immunol 8, 726–736 (2008).
- Margiana, R. et al. Clinical application of mesenchymal stem cell in regenerative medicine: a narrative review. Stem Cell Res Ther 13, 366 (2022).
- Fernández-Garza, L. E., Barrera-Barrera, S. A. & Barrera-Saldaña, H. A. Mesenchymal Stem Cell Therapies Approved by Regulatory Agencies around the World.Pharmaceuticals 16, 1334 (2023).
- Jayankura, M. et al. Percutaneous administration of allogeneic bone-forming cells for the treatment of delayed unions of fractures: a pilot study. Stem Cell ResTher 12, 363 (2021).
- Hernigou, P., Delambre, J., Quiennec, S. & Poignard, A. Human bone marrow mesenchymal stem cell injection in subchondral lesions of knee osteoarthritis: aprospective randomized study versus contralateral arthroplasty at a mean fifteen year follow-up. Int Orthop 45, 365–373 (2021).
- Falanga, V. et al. Autologous Bone Marrow–Derived Cultured Mesenchymal Stem Cells Delivered in a Fibrin Spray Accelerate Healing in Murine and HumanCutaneous Wounds. Tissue Eng 13, 1299–1312 (2007).
- Hertegård, S., Nagubothu, S. R., Malmström, E. & LeBlanc, K. Treatment of vocal fold scarring with autologous bone marrow-derived human mesenchymal stro-mal cells—first phase I/II human clinical study. Stem Cell Res Ther 11, 128 (2020).
- Staff, N. P. et al. Safety of intrathecal autologous adipose-derived mesenchymal stromal cells in patients with ALS. Neurology 87, 2230–2234 (2016).
- Canesi, M. et al. Finding a new therapeutic approach for no-option Parkinsonisms: mesenchymal stromal cells for progressive supranuclear palsy. JTranslMed 14, 127 (2016).
- Jaillard, A. et al. Autologous Mesenchymal Stem Cells Improve Motor Recovery in Subacute Ischemic Stroke: a Randomized Clinical Trial. Transl StrokeRes 11, 910–923 (2020).
- Gao, L. R. et al. Intracoronary infusion of Wharton’s jelly-derived mesenchymal stem cells in acute myocardial infarction: double-blind, randomized controlledtrial. BMC Med 13, 162 (2015).
- Jasim, S. A. et al. Shining the light on clinical application of mesenchymal stem cell therapy in autoimmune diseases. Stem Cell Res Ther 13, 101 (2022).
- Lan, T., Luo, M. & Wei, X. Mesenchymal stem/stromal cells in cancer therapy. J Hematol Oncol 14, 195 (2021).
- Ullah, M., Liu, D. D. & Thakor, A. S. Mesenchymal Stromal Cell Homing: Mechanisms and Strategies for Improvement. iScience 15, 421–438 (2019).
- Chang, C. et al. Effects of Mesenchymal Stem Cell-Derived Paracrine Signals and Their Delivery Strategies. Adv Healthc Mater 10, 2001689 (2021).
- Song, N., Scholtemeijer, M. & Shah, K. Mesenchymal Stem Cell Immunomodulation: Mechanisms and Therapeutic Potential. TrendsPharmacol Sci 41, 653–664 (2020).
- Musiał-Wysocka, A., Kot, M. & Majka, M. The Pros and Cons of Mesenchymal Stem Cell-Based Therapies. Cell Transplant 28, 801–812 (2019).
- Hmadcha, A., Martin-Montalvo, A., Gauthier, B. R., Soria, B. & Capilla-Gonzalez, V. Therapeutic Potential of Mesenchymal Stem Cells for Cancer Therapy. Front BioengBiotechnol 8, (2020).
Bài dịch từ trang https://www.drugdiscoverynews.com