
Exosome
Exosome, có kích thước từ 30 đến 150 nanomet [1], là các túi ngoại bào (EVs) có màng bao bọc, được sản xuất trong khoang nội bào của hầu hết tế bào nhân chuẩn [2][3][4]. Ở sinh vật đa bào, exosome và các EVs khác được tìm thấy trong dịch sinh học như nước bọt, máu, nước tiểu và dịch não tủy [5]. EVs đóng vai trò chuyên biệt trong các quá trình sinh lý, từ đông máu, quản lý chất thải đến giao tiếp giữa các tế bào [6].
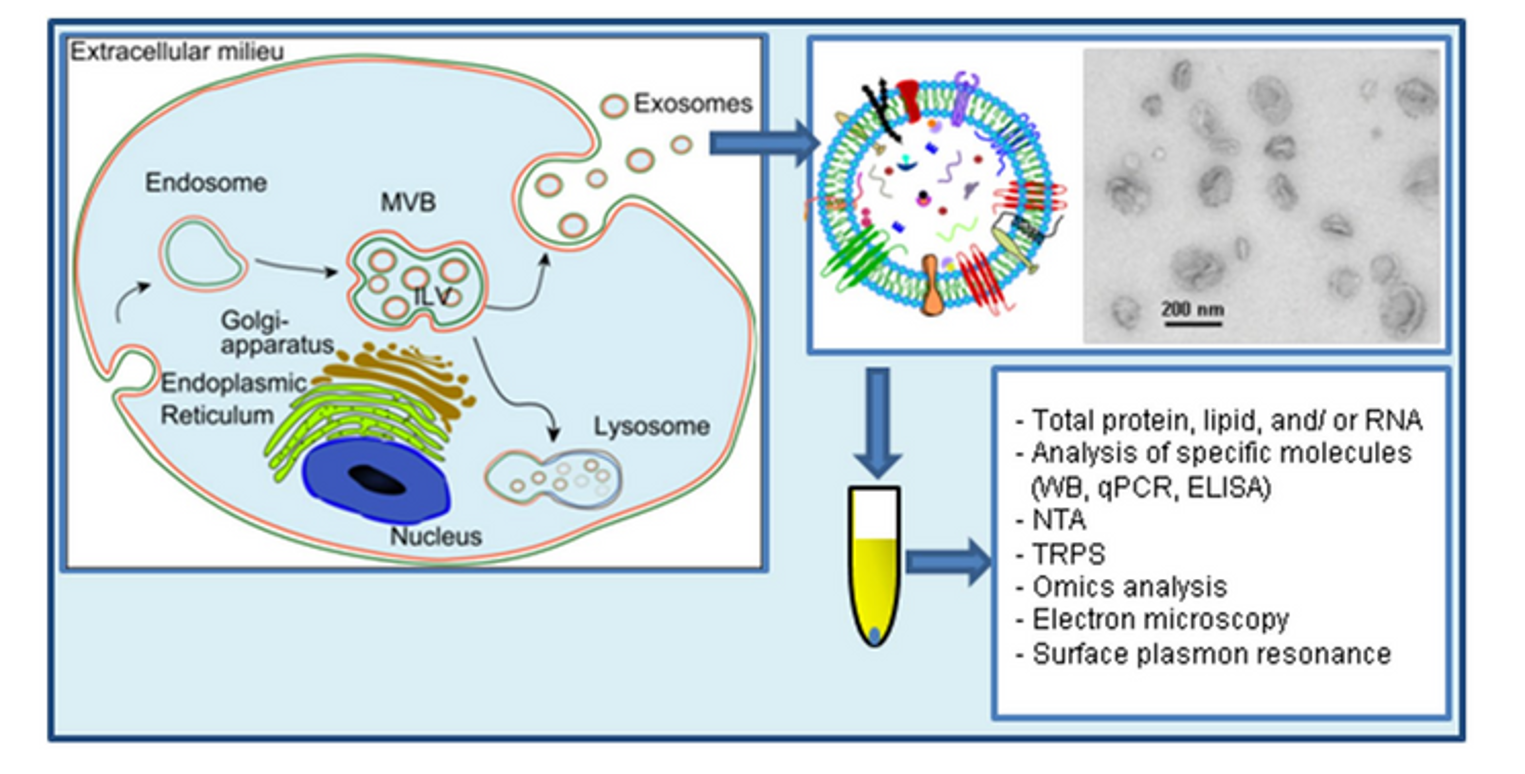
Exosome hình thành thông qua sự nảy chồi vào trong của endosome muộn (còn gọi là thể đa túi – MVB) [7]. Các túi nội mạch (ILVs) trong MVB nảy chồi vào lòng endosome. Nếu MVB hợp nhất với màng tế bào (màng sinh chất), các ILVs này sẽ được giải phóng dưới dạng exosome [8]. Exosome cũng được xác định trong ma trận mô, gọi là Túi nano liên kết ma trận (MBV) [9]. Chúng còn được các tế bào nuôi cấy giải phóng vào môi trường phát triển trong ống nghiệm [6][10][11]. Exosome chứa nhiều thành phần sinh học đa dạng từ tế bào nguồn, bao gồm protein (như phân tử kết dính, bộ xương tế bào, cytokine, protein ribosome, yếu tố tăng trưởng, enzyme chuyển hóa), lipid (cholesterol, bè lipid, ceramide) và axit nucleic (DNA, mRNA, miRNA) [12]. Do kích thước exosome bị giới hạn bởi MVB gốc, chúng thường nhỏ hơn các EVs khác (khoảng 30–150 nm), tương đương lipoprotein nhưng nhỏ hơn nhiều so với tế bào [13][6]. So với EVs nói chung, vẫn chưa rõ liệu exosome có đặc điểm/chức năng độc đáo hay có thể tách biệt hiệu quả khỏi các EVs khác [2].
EVs lưu thông mang vật liệu di truyền và protein từ tế bào gốc, tạo ra chữ ký proteo-transcriptome đóng vai trò chất chỉ điểm sinh học [7][5][6][14]. Trong tế bào ung thư, exosome có thể khác biệt về kích thước, hình dạng, hình thái và dấu ấn so với tế bào gốc, chứa thông tin hữu ích cho chẩn đoán bệnh [5]. Do đó, ứng dụng lâm sàng của EVs như chất chỉ điểm sinh học và liệu pháp đang được quan tâm [15], dẫn đến sự ra đời của Hiệp hội Quốc tế về Túi Ngoại bào (ISEV) và tạp chí chuyên ngành Journal of Extracellular Vesicles.
Bối cảnh
Exosome lần đầu được phát hiện trong hồng cầu lưới (tế bào hồng cầu non) của động vật có vú bởi Stahl và cộng sự năm 1983 [16], sau đó được Johnstone và nhóm nghiên cứu năm 1983 [17] đặt tên “exosome” vào năm 1987 [18]. Exosome tham gia vào quá trình loại bỏ chọn lọc nhiều protein màng sinh chất khi hồng cầu lưới trưởng thành [19]. Ở tế bào này, phần lớn màng sinh chất được tái chế mỗi giờ thông qua nội bào hóa thành endosome [20]. p Một số endosome tiếp tục hình thành các túi nhỏ bên trong, gọi là thể đa túi (MVB). Các ILVs trong MVB trở thành exosome khi MVB hợp nhất với màng tế bào, giải phóng chúng ra ngoại bào [21].
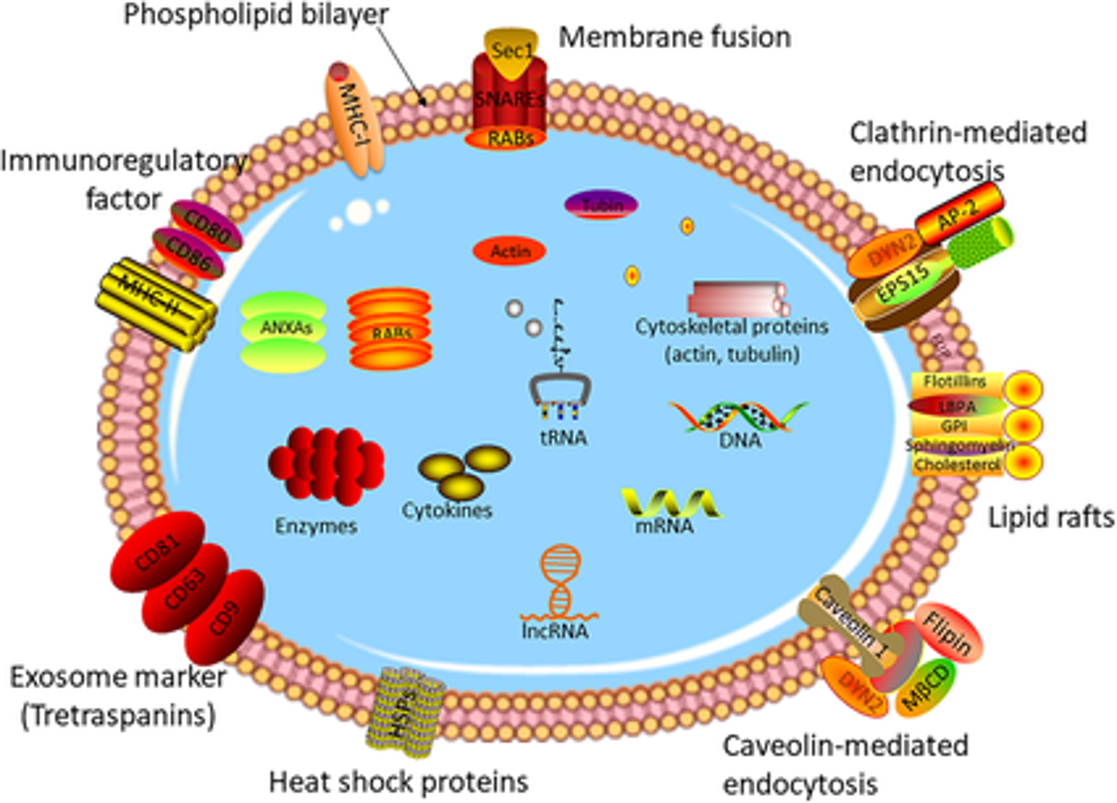
Exosome chứa các thành phần phân tử từ tế bào gốc, bao gồm protein và RNA. Dù thành phần protein thay đổi tùy loại tế bào/mô, hầu hết exosome đều có một bộ protein bảo tồn qua tiến hóa. Một exosome đơn lẻ có thể chứa khoảng 20.000 phân tử protein [22]. Cargo mRNA và miRNA trong exosome lần đầu được phát hiện tại Đại học Gothenburg, Thụy Điển [23]. Nội dung exosome thay đổi phản ánh tế bào gốc, giúp theo dõi bệnh lý [24]. Nghiên cứu này cũng mô tả sự khác biệt giữa mRNA/miRNA trong tế bào và exosome, cũng như chức năng của mRNA trong exosome. Exosome còn mang DNA sợi kép [25].
Exosome có thể chuyển phân tử giữa các tế bào thông qua vận chuyển màng túi, ảnh hưởng đến hệ miễn dịch (tế bào tua, tế bào B) và tham gia vào đáp ứng miễn dịch thích ứng với mầm bệnh/ung thư [26][27]. Nhiều giả thuyết cho rằng RNA trong exosome (như mRNA, miRNA) có thể điều chỉnh sản xuất protein ở tế bào nhận [23][28][29]. Tuy nhiên, một nghiên cứu chỉ ra rằng miRNA trong exosome từ tế bào gốc trung mô (MSC) chủ yếu là tiền miRNA, không phải miRNA trưởng thành [30]. Do không tìm thấy protein liên quan đến phức hợp bất hoạt RNA (RISC) trong exosome, các tác giả cho rằng chỉ tiền miRNA mới có hoạt tính sinh học ở tế bào nhận. Cơ chế tải miRNA vào exosome bao gồm: motif đặc hiệu trên trình tự miRNA, tương tác với lncRNA, protein liên kết RNA (RBPs), và biến đổi hậu dịch mã của Ago [31]. Ngược lại, quá trình sản xuất và nội dung exosome có thể bị ảnh hưởng bởi tín hiệu phân tử mà tế bào gốc nhận được. Ví dụ, tế bào ung thư trong môi trường thiếu oxy tiết exosome có khả năng tạo mạch và di căn cao hơn, cho thấy exosome giúp khối u thích nghi bằng cách kích thích hình thành mạch hoặc di căn [32].
Chức năng RNA liên quan đến Túi Ngoại bào
Dù giả thuyết RNA exosome có chức năng sinh học ở tế bào nhận hấp dẫn, bằng chứng chắc chắn về **chuyển RNA ngoại bào (exRNA)** ở động vật có vú vẫn còn hạn chế. Sự hiện diện của RNA trong túi ngoại bào không đồng nghĩa với chức năng, do RNA có thể bị phân hủy, giải phóng thụ động hoặc nhiễm từ mảnh vụn tế bào [33].
Thuật ngữ
Cần thống nhất rằng thuật ngữ “exosome” chỉ áp dụng cho EVs có nguồn gốc từ endosome. Do khó xác định nguồn gốc sau khi EVs rời tế bào, nên dùng “túi ngoại bào” để thay thế [2][34].
Nghiên cứu
Exosome từ hồng cầu chứa thụ thể transferrin vắng mặt ở hồng cầu trưởng thành. Exosome từ tế bào tua biểu hiện MHC I, MHC II và phân tử kích thích, có khả năng kích hoạt đáp ứng tế bào T đặc hiệu kháng nguyên in vivo [35]. Exosome cũng được thận bài tiết vào nước tiểu, có tiềm năng làm công cụ chẩn đoán [36][37][38]. Exosome nước tiểu có thể đánh giá đáp ứng điều trị ung thư tuyến tiền liệt [39][40]. Exosome từ khối u truyền tín hiệu điều hòa biệt hóa tế bào cơ trơn [41]. Trong ung thư hắc tố, túi từ khối u xâm nhập hệ bạch huyết và tương tác với đại thực bào/hạch bạch huyết [42]. Exosome tương quan với tính xâm lấn của ung thư buồng trứng [43]. Exosome trong máu ổn định, có tiềm năng chẩn đoán [44][45]. Mẫu máu lưu trữ trong ngân hàng sinh học có thể phục hồi exosome từ tế bào ung thư đại trực tràng sau 90 ngày [46].
Trong ung thư, exosome bị lợi dụng để tăng khả năng sống sót và di căn [47][29]. Ở ung thư vú, neratinib (chất ức chế ERBB) làm giảm HER2 trong exosome, hạn chế di căn [48]. Exosome nước tiểu cũng giúp phát hiện ung thư tiết niệu và tăng huyết áp khoáng corticoid thông qua protein và miRNA [49][15].
Với bệnh thoái hóa thần kinh, exosome tham gia lan truyền alpha-synuclein và đang được nghiên cứu để theo dõi bệnh, phân phối thuốc và liệu pháp tế bào gốc [50]. Một cơ sở dữ liệu mở về exosome đã được xây dựng để thúc đẩy nghiên cứu [50].
Exosome và Giao tiếp Liên tế bào
Exosome có thể hợp nhất với tế bào đích và giải phóng nội dung, ảnh hưởng đến quá trình sinh học ở tế bào nhận [51]. Ví dụ, “RNA exosome” chuyển từ tế bào này sang tế bào khác có thể điều chỉnh sản xuất protein [28][23]. Exosome từ tế bào miễn dịch (tế bào tua, tế bào B) tham gia vào đáp ứng miễn dịch thích ứng [26][42]. Xuất khẩu miRNA qua exosome cũng liên quan đến điều hòa mức miRNA nội bào [53].
Ngược lại, tín hiệu phân tử nhận bởi tế bào gốc ảnh hưởng đến exosome. Ví dụ, tế bào ung thư trong môi trường thiếu oxy tiết exosome tăng cường tạo mạch và di căn [32]. Thành phần protein exosome thay đổi trong quá trình tiến triển bệnh bạch cầu lympho mạn tính [54].
Một nghiên cứu giả thuyết rằng exosome từ khối u “chuẩn bị” vị trí di căn bằng cách trồng thông tin (như RNA) vào tế bào đích, ngay cả khi tế bào ung thư không còn khả năng nhân đôi [55].
Exosome chứa cargo kích hoạt miễn dịch bẩm sinh. Ví dụ, exosome từ đại thực bào nhiễm Salmonella kích thích tiết cytokine tiền viêm (TNF-α, IL-1ra…) nhờ lipopolysaccharide trong túi [56].
Trong quá trình làm tổ, exosome đóng vai trò trao đổi protein, glycoprotein, DNA và mRNA giữa phôi và mẹ [57].
Sinh tổng hợp, Bài tiết và Hấp thu Exosome
Sinh tổng hợp
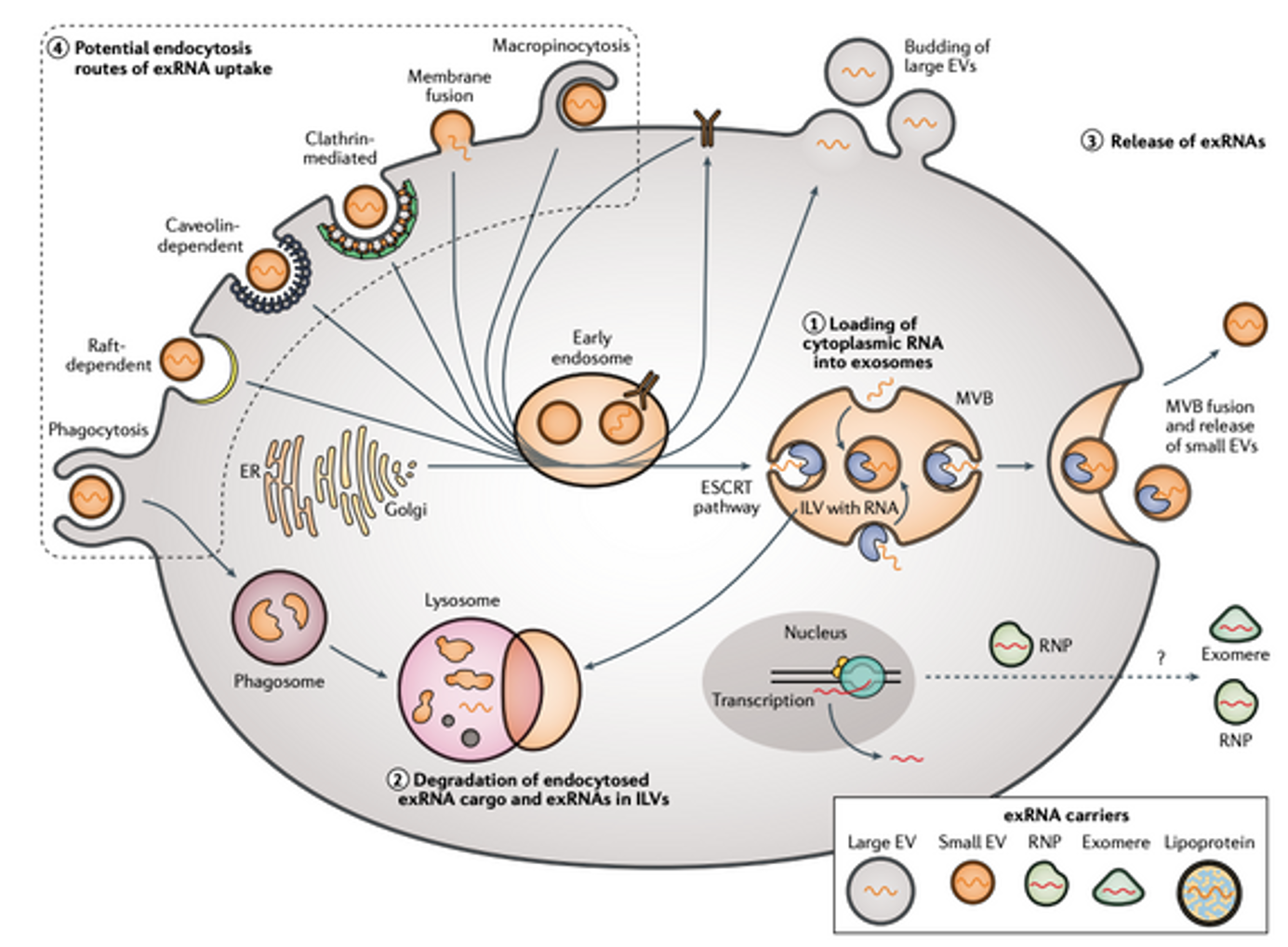
Exosome là các túi ngoại bào được hình thành thông qua con đường đa túi (multivesicular bodies – MVBs). Quá trình tạo exosome bắt đầu từ sự lõm vào của thể đa túi (MVB) hoặc endosome muộn để tạo ra các túi nội mạch (ILVs) [58]. Cơ chế hình thành MVB, sự nảy chồi túi và phân loại được đề xuất gồm hai con đường chính:
- Con đường phụ thuộc ESCRT: Hệ thống ESCRT (phức hợp cần thiết cho vận chuyển nội bào) bao gồm các phức hợp protein ESCRT-0, -I, -II, -III và ATPase Vps4. ESCRT-0 nhận biết protein ubiquitin hóa để đóng gói vào màng endosome muộn. ESCRT I/II tạo sự lõm vào màng, ESCRT-III hình thành cấu trúc xoắn thắt cổ túi, và ATPase VPS4 cắt màng [59].
- Con đường không phụ thuộc ESCRT: Ví dụ là con đường Syndecan-syntenin-ALIX, liên quan đến sự tương tác giữa syndecan, syntenin và protein ALIX [60].
Hấp thu Exosome
Exosome nhắm đích thông qua tương tác protein, đường, lipid hoặc vi nhập bào. Sau khi nội bào hóa, exosome giải phóng vật chất vào tế bào nhận thông qua endosome [62][63].
Bài tiết Exosome
MVB sau khi hình thành được vận chuyển đến màng sinh chất. Các MVB giàu cholesterol dễ hợp nhất với màng sinh chất để giải phóng exosome [61]. Protein Rab (đặc biệt Rab7) trên MVB nhận biết thụ thể đích, trong khi phức hợp SNARE (soluble N-ethylmaleimide-sensitive fusion attachment protein receptor) điều khiển sự hợp nhất màng [58].
Phân loại và Đóng gói Vật chất trong Exosome
Exosome chứa protein, lipid, axit nucleic được đóng gói chọn lọc:
- microRNA (exomiR): Được phân loại nhờ motif GGAG (EXOmotif) liên kết với protein hnRNP A2B1 [64].
- Protein: Phụ thuộc ESCRT, tetraspanin hoặc cơ chế lipid.
- Lipid: Giàu cholesterol, sphingomyelin, phosphatidylcholine bão hòa và phosphatidylethanolamine so với màng sinh chất [65].
Phân lập Exosome
Các phương pháp phân lập gồm:
- Ly tâm siêu tốc (Siêu li tâm): Dễ lẫn tạp chất, cần kết hợp lọc vi hoặc gradient [67][68].
- Sắc ký kích thước (SEC): Hiệu quả hơn ly tâm nhưng không phân biệt được exosome với túi khác [70][71].
- Kỹ thuật vi lỏng (microfluidic): Sử dụng cấu trúc nano, từ tính, lọc, hoặc điện động học để tăng độ tinh khiết [77].
Phát hiện Exosome
Do kích thước nhỏ, exosome đòi hỏi công nghệ cao:
- Vi cảm biến: microNMR, chip nano plasmon, cảm biến điện từ [79][80][81].
- Kính hiển vi: Lực nguyên tử (AFM), điện tử truyền qua (TEM) [84][83].
- Phân tích theo dõi hạt (NTA): Đo kích thước và nồng độ [85].


Phân tích Tin sinh học
Exosome chứa RNA, protein phản ánh nguồn gốc tế bào. Công cụ như FunRich phân tích dữ liệu proteomics/transcriptomics [87]. Nghiên cứu RNA-Seq exosome từ Trypanosoma cruzi giúp tìm dấu ấn sinh học cho bệnh Chagas [88].
Ứng dụng Trị liệu và Vận chuyển Thuốc
- Làm lành vết thương: Exosome từ tế bào sừng hóa miệng thúc đẩy liền da [89].
- Giảm đau: Tiêm ngoài màng cứng hoặc khớp mặt giảm đau lưng [90].
- Chống lão hóa: Exosome chứa superoxide dismutase kéo dài tuổi thọ ở giun C. elegans [91].
- Vận chuyển thuốc: Exosome tải doxorubicin, paclitaxel nhắm đích khối u, vượt hàng rào máu-não [93][94].
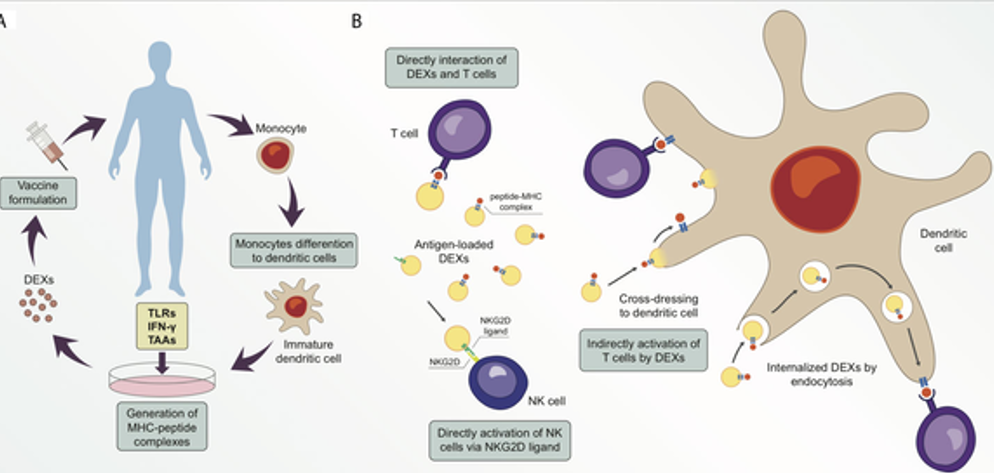
- Thử nghiệm lâm sàng: Vắc-xin exosome từ tế bào tua (DC) cho ung thư, tiểu đường [92].
Quảng cáo Không được Phê duyệt
Nhiều công ty tại Mỹ tiếp thị exosome chưa kiểm chứng cho các bệnh như COVID-19, lão hóa, đau khớp. FDA cảnh báo:
- Exosome là sản phẩm sinh học cần phê duyệt trước [95][96].
- Một số lợi dụng nhãn “mỹ phẩm” để tránh kiểm soát [101].
- Rủi ro: Viêm nhiễm, tổn thương nghiêm trọng do sản phẩm chưa kiểm định [99][100].
Kết luận: Exosome có tiềm năng lớn trong y học nhưng đòi hỏi nghiên cứu chuyên sâu và quản lý chặt để đảm bảo an toàn, hiệu quả.
TÀI LIỆU THAM KHẢO
- Moghassemi S, Dadashzadeh A, Sousa MJ, Vlieghe H, Yang J, León-Félix CM, et al. (June 2024). “Extracellular vesicles in nanomedicine and regenerative medicine: A review over the last decade”. Bioactive Materials. 36: 126–156. doi:10.1016/j.bioactmat.2024.02.021. PMC 10915394. PMID 38450204
- Théry C, Witwer KW, Aikawa E, Alcaraz MJ, Anderson JD, Andriantsitohaina R, et al. (2018). “Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines”. Journal of Extracellular Vesicles. 7 (1): 1535750. doi:10.1080/20013078.2018.1535750. PMC 6322352. PMID 30637094.
- Yáñez-Mó M, Siljander PR, Andreu Z, Zavec AB, Borràs FE, Buzas EI, et al. (2015). “Biological properties of extracellular vesicles and their physiological functions”. Journal of Extracellular Vesicles. 4: 27066. doi:10.3402/jev.v4.27066. PMC 4433489. PMID 25979354.
- van Niel G, D’Angelo G, Raposo G (April 2018). “Shedding light on the cell biology of extracellular vesicles” (PDF). Nature Reviews. Molecular Cell Biology. 19 (4): 213–228. doi:10.1038/nrm.2017.125. PMID 29339798. S2CID 3944339.
- Nonaka T, Wong DT (June 2022). “Saliva Diagnostics”. Annual Review of Analytical Chemistry. 15 (1): 107–121. Bibcode:2022ARAC…15..107N. doi:10.1146/annurev-anchem-061020-123959. PMC 9348814. PMID 35696523.
- van der Pol E, Böing AN, Harrison P, Sturk A, Nieuwland R (July 2012). “Classification, functions, and clinical relevance of extracellular vesicles”. Pharmacological Reviews. 64 (3): 676–705. doi:10.1124/pr.112.005983. PMID 22722893. S2CID 7764903.
- Chen TY, Gonzalez-Kozlova E, Soleymani T, La Salvia S, Kyprianou N, Sahoo S, et al. (June 2022). “Extracellular vesicles carry distinct proteo-transcriptomic signatures that are different from their cancer cell of origin”. iScience. 25 (6): 104414. Bibcode:2022iSci…25j4414C. doi:10.1016/j.isci.2022.104414. PMC 9157216. PMID 35663013.
- Janas AM, Sapoń K, Janas T, Stowell MH, Janas T (June 2016). “Exosomes and other extracellular vesicles in neural cells and neurodegenerative diseases”. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1858 (6): 1139–1151. doi:10.1016/j.bbamem.2016.02.011. PMID 26874206.
- Huleihel L, Hussey GS, Naranjo JD, Zhang L, Dziki JL, Turner NJ, et al. (June 2016). “Matrix-bound nanovesicles within ECM bioscaffolds”. Science Advances. 2 (6): e1600502. Bibcode:2016SciA….2E0502H. doi:10.1126/sciadv.1600502. PMC 4928894. PMID 27386584.
- Keller S, Sanderson MP, Stoeck A, Altevogt P (November 2006). “Exosomes: from biogenesis and secretion to biological function”. Immunology Letters. 107 (2): 102–8. doi:10.1016/j.imlet.2006.09.005. PMID 17067686.
- Spaull R, McPherson B, Gialeli A, Clayton A, Uney J, Heep A, et al. (April 2019). “Exosomes populate the cerebrospinal fluid of preterm infants with post-haemorrhagic hydrocephalus” (PDF). International Journal of Developmental Neuroscience. 73: 59–65. doi:10.1016/j.ijdevneu.2019.01.004. PMID 30639393. S2CID 58561998.
- Moghassemi S, Dadashzadeh A, Sousa MJ, Vlieghe H, Yang J, León-Félix CM, et al. (June 2024). “Extracellular vesicles in nanomedicine and regenerative medicine: A review over the last decade”. Bioactive Materials. 36: 126–156. doi:10.1016/j.bioactmat.2024.02.021. PMC 10915394. PMID 38450204.
- Rudraprasad D, Rawat A, Joseph J (January 2022). “Exosomes, extracellular vesicles and the eye”. Experimental Eye Research. 214: 108892. doi:10.1016/j.exer.2021.108892. PMID 34896308. S2CID 245028439.
- Loewy MA (14 March 2023). “Saliva: The next frontier in cancer detection”. Knowable Magazine. Annual Reviews. doi:10.1146/knowable-031323-1. S2CID 257541737.
- Dhondt B, Van Deun J, Vermaerke S, de Marco A, Lumen N, De Wever O, et al. (June 2018). “Urinary extracellular vesicle biomarkers in urological cancers: From discovery towards clinical implementation”. The International Journal of Biochemistry & Cell Biology. 99: 236–256. doi:10.1016/j.biocel.2018.04.009. PMID 29654900. S2CID 4876604.
- Harding C, Stahl P (June 1983). “Transferrin recycling in reticulocytes: pH and iron are important determinants of ligand binding and processing”. Biochemical and Biophysical Research Communications. 113 (2): 650–8. doi:10.1016/0006-291X(83)91776-X. PMID 6870878.
- Pan BT, Johnstone RM (July 1983). “Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor”. Cell. 33 (3): 967–78. doi:10.1016/0092-8674(83)90040-5. PMID 6307529. S2CID 33216388.
- Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C (July 1987). “Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)”. The Journal of Biological Chemistry. 262 (19): 9412–20. doi:10.1016/S0021-9258(18)48095-7. PMID 3597417.
- van Niel G, Porto-Carreiro I, Simoes S, Raposo G (July 2006). “Exosomes: a common pathway for a specialized function”. Journal of Biochemistry. 140 (1): 13–21. doi:10.1093/jb/mvj128. PMID 16877764. S2CID 43541754.
- Huotari J, Helenius A (August 2011). “Endosome maturation”. The EMBO Journal. 30 (17): 3481–500. doi:10.1038/emboj.2011.286. PMC 3181477. PMID 21878991.
- Gruenberg J, van der Goot FG (July 2006). “Mechanisms of pathogen entry through the endosomal compartments”. Nature Reviews. Molecular Cell Biology. 7 (7): 495–504. doi:10.1038/nrm1959. PMID 16773132. S2CID 429568.
- Maguire G (January 2016). “Exosomes: smart nanospheres for drug delivery naturally produced by stem cells.”. In Grumezescu AM (ed.). Fabrication and Self-Assembly of Nanobiomaterials. Vol. 1. William Andrew Publishing. pp. 179–209. doi:10.1016/B978-0-323-41533-0.00007-6. ISBN 978-0-323-41533-0.
- Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO (June 2007). “Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells”. Nature Cell Biology. 9 (6): 654–9. doi:10.1038/ncb1596. PMID 17486113. S2CID 8599814.
- Nuzhat Z, Kinhal V, Sharma S, Rice GE, Joshi V, Salomon C (March 2017). “Tumour-derived exosomes as a signature of pancreatic cancer – liquid biopsies as indicators of tumour progression”. Oncotarget. 8 (10): 17279–17291. doi:10.18632/oncotarget.13973. PMC 5370040. PMID 27999198.
- Thakur BK, Zhang H, Becker A, Matei I, Huang Y, Costa-Silva B, et al. (June 2014). “Double-stranded DNA in exosomes: a novel biomarker in cancer detection”. Cell Research. 24 (6): 766–9. doi:10.1038/cr.2014.44. PMC 4042169. PMID 24710597.
- Li XB, Zhang ZR, Schluesener HJ, Xu SQ (2006). “Role of exosomes in immune regulation”. Journal of Cellular and Molecular Medicine. 10 (2): 364–75. doi:10.1111/j.1582-4934.2006.tb00405.x. PMC 3933127. PMID 16796805.
- Hough KP, Chanda D, Duncan SR, Thannickal VJ, Deshane JS (April 2017). “Exosomes in immunoregulation of chronic lung diseases”. Allergy. 72 (4): 534–544. doi:10.1111/all.13086. PMC 5462600. PMID 27859351.
- Balaj L, Lessard R, Dai L, Cho YJ, Pomeroy SL, Breakefield XO, et al. (February 2011). “Tumour microvesicles contain retrotransposon elements and amplified oncogene sequences”. Nature Communications. 2 (2): 180. Bibcode:2011NatCo…2..180B. doi:10.1038/ncomms1180. PMC 3040683. PMID 21285958.
- Oushy S, Hellwinkel JE, Wang M, Nguyen GJ, Gunaydin D, Harland TA, et al. (January 2018). “Glioblastoma multiforme-derived extracellular vesicles drive normal astrocytes towards a tumour-enhancing phenotype”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 373 (1737): 20160477. doi:10.1098/rstb.2016.0477. PMC 5717433. PMID 29158308.
- Chen TS, Lai RC, Lee MM, Choo AB, Lee CN, Lim SK (January 2010). “Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs”. Nucleic Acids Research. 38 (1): 215–24. doi:10.1093/nar/gkp857. PMC 2800221. PMID 19850715.
- 31. Gebert LF, MacRae IJ (January 2019). “Regulation of microRNA function in animals”. Nature Reviews. Molecular Cell Biology. 20 (1): 21–37. doi:10.1038/s41580-018-0045-7. PMC 6546304. PMID 30108335.
- Park JE, Tan HS, Datta A, Lai RC, Zhang H, Meng W, et al. (June 2010). “Hypoxic tumor cell modulates its microenvironment to enhance angiogenic and metastatic potential by secretion of proteins and exosomes”. Molecular & Cellular Proteomics. 9 (6): 1085–99. doi:10.1074/mcp.M900381-MCP200. PMC 2877972. PMID 20124223.
- Gruner HN, McManus MT (July 2021). “Examining the evidence for extracellular RNA function in mammals”. Nature Reviews Genetics. 22 (7): 448–458. doi:10.1038/s41576-021-00346-8. PMID 33824487.
- Witwer KW, Théry C (2019). “Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature”. Journal of Extracellular Vesicles. 8 (1): 1648167. doi:10.1080/20013078.2019.1648167. PMC 6711079. PMID 31489144.
- Mignot G, Roux S, Thery C, Ségura E, Zitvogel L (2006). “Prospects for exosomes in immunotherapy of cancer”. Journal of Cellular and Molecular Medicine. 10 (2): 376–88. doi:10.1111/j.1582-4934.2006.tb00406.x. PMC 3933128. PMID 16796806.
- Pisitkun T, Shen RF, Knepper MA (September 2004). “Identification and proteomic profiling of exosomes in human urine”. Proceedings of the National Academy of Sciences of the United States of America. 101 (36): 13368–73. Bibcode:2004PNAS..10113368P. doi:10.1073/pnas.0403453101. PMC 516573. PMID 15326289.
- “Urinary Exosome Protein Database”. NHLBI. 2009-05-12. Retrieved 2009-10-01.
- Nilsson J, Skog J, Nordstrand A, Baranov V, Mincheva-Nilsson L, Breakefield XO, et al. (May 2009). “Prostate cancer-derived urine exosomes: a novel approach to biomarkers for prostate cancer”. British Journal of Cancer. 100 (10): 1603–7. doi:10.1038/sj.bjc.6605058. PMC 2696767. PMID 19401683.
- “Fat capsules carry markers for deadly prostate cancer”. The Medical News. 2009-05-13. Retrieved 2009-10-01.
- Mitchell PJ, Welton J, Staffurth J, Court J, Mason MD, Tabi Z, et al. (January 2009). “Can urinary exosomes act as treatment response markers in prostate cancer?”. Journal of Translational Medicine. 7 (1): 4. doi:10.1186/1479-5876-7-4. PMC 2631476. PMID 19138409.
- Webber J, Steadman R, Mason MD, Tabi Z, Clayton A (December 2010). “Cancer exosomes trigger fibroblast to myofibroblast differentiation”. Cancer Research. 70 (23): 9621–30. doi:10.1158/0008-5472.CAN-10-1722. PMID 21098712.
- Pucci F, Garris C, Lai CP, Newton A, Pfirschke C, Engblom C, et al. (April 2016). “SCS macrophages suppress melanoma by restricting tumor-derived vesicle-B cell interactions”. Science. 352 (6282): 242–6. Bibcode:2016Sci…352..242P. doi:10.1126/science.aaf1328. PMC 4960636. PMID 26989197.
- Kobayashi M, Salomon C, Tapia J, Illanes SE, Mitchell MD, Rice GE (January 2014). “Ovarian cancer cell invasiveness is associated with discordant exosomal sequestration of Let-7 miRNA and miR-200”. Journal of Translational Medicine. 12: 4. doi:10.1186/1479-5876-12-4. PMC 3896684. PMID 24393345.
- Williams C, Royo F, Aizpurua-Olaizola O, Pazos R, Boons GJ, Reichardt NC, et al. (2018). “Glycosylation of extracellular vesicles: current knowledge, tools and clinical perspectives”. Journal of Extracellular Vesicles. 7 (1): 1442985. doi:10.1080/20013078.2018.1442985. PMC 5844028. PMID 29535851.
- Aizpurua-Olaizola O, Toraño JS, Falcon-Perez JM, Williams C, Reichardt N, Boons GJ (2018). “Mass spectrometry for glycan biomarker discovery”. TrAC Trends in Analytical Chemistry. 100: 7–14. doi:10.1016/j.trac.2017.12.015. hdl:1874/364403.
- Kalra H, Adda CG, Liem M, Ang CS, Mechler A, Simpson RJ, et al. (November 2013). “Comparative proteomics evaluation of plasma exosome isolation techniques and assessment of the stability of exosomes in normal human blood plasma”. Proteomics. 13 (22): 3354–64. doi:10.1002/pmic.201300282. PMID 24115447. S2CID 45991971.
- Syn N, Wang L, Sethi G, Thiery JP, Goh BC (July 2016). “Exosome-Mediated Metastasis: From Epithelial-Mesenchymal Transition to Escape from Immunosurveillance”. Trends in Pharmacological Sciences. 37 (7): 606–617. doi:10.1016/j.tips.2016.04.006. PMID 27157716.
- Santamaria S, Gagliani MC, Bellese G, Marconi S, Lechiara A, Dameri M, et al. (July 2021). “Imaging of Endocytic Trafficking and Extracellular Vesicles Released Under Neratinib Treatment in ERBB2+ Breast Cancer Cells”. The Journal of Histochemistry and Cytochemistry. 69 (7): 461–473. doi:10.1369/00221554211026297. PMC 8246527. PMID 34126793.
- Barros ER, Carvajal CA (2017-09-08). “Urinary Exosomes and Their Cargo: Potential Biomarkers for Mineralocorticoid Arterial Hypertension?”. Frontiers in Endocrinology. 8: 230. doi:10.3389/fendo.2017.00230. PMC 5599782. PMID 28951728.
- Tofaris GK (2017). “A Critical Assessment of Exosomes in the Pathogenesis and Stratification of Parkinson’s Disease”. Journal of Parkinson’s Disease. 7 (4): 569–576. doi:10.3233/JPD-171176. PMC 5676982. PMID 28922170.
- Dhondt B, Rousseau Q, De Wever O, Hendrix A (September 2016). “Function of extracellular vesicle-associated miRNAs in metastasis”. Cell and Tissue Research. 365 (3): 621–41. doi:10.1007/s00441-016-2430-x. hdl:1854/LU-7250365. PMID 27289232. S2CID 2746182.
- Samuelson I, Vidal-Puig AJ (May 2018). “Fed-EXosome: extracellular vesicles and cell-cell communication in metabolic regulation”. Essays in Biochemistry. 62 (2): 165–175. doi:10.1042/EBC20170087. PMID 29717059.
- Ghosh S, Bose M, Ray A, Bhattacharyya SN (March 2015). “Polysome arrest restricts miRNA turnover by preventing exosomal export of miRNA in growth-retarded mammalian cells”. Molecular Biology of the Cell. 26 (6): 1072–83. doi:10.1091/mbc.E14-11-1521. PMC 4357507. PMID 25609084.
- Prieto D, Sotelo N, Seija N, Sernbo S, Abreu C, Durán R, et al. (August 2017). “S100-A9 protein in exosomes from chronic lymphocytic leukemia cells promotes NF-κB activity during disease progression”. Blood. 130 (6): 777–788. doi:10.1182/blood-2017-02-769851. hdl:20.500.12008/31377. PMID 28596424.
- Hoshino A, Costa-Silva B, Shen TL, Rodrigues G, Hashimoto A, Tesic Mark M, et al. (November 2015). “Tumour exosome integrins determine organotropic metastasis”. Nature. 527 (7578): 329–35. Bibcode:2015Natur.527..329H. doi:10.1038/nature15756. PMC 4788391. PMID 26524530.
- Hui WW, Hercik K, Belsare S, Alugubelly N, Clapp B, Rinaldi C, et al. (February 2018). “Salmonella enterica Serovar Typhimurium Alters the Extracellular Proteome of Macrophages and Leads to the Production of Proinflammatory Exosomes”. Infection and Immunity. 86 (2): e00386–17. doi:10.1128/IAI.00386-17. PMC 5778363. PMID 29158431.
- Kurian NK, Modi D (February 2019). “Extracellular vesicle mediated embryo-endometrial cross talk during implantation and in pregnancy”. Journal of Assisted Reproduction and Genetics. 36 (2): 189–198. doi:10.1007/s10815-018-1343-x. PMC 6420537. PMID 30362057.
- Hessvik NP, Llorente A (January 2018). “Current knowledge on exosome biogenesis and release”. Cellular and Molecular Life Sciences. 75 (2): 193–208. doi:10.1007/s00018-017-2595-9. PMC 5756260. PMID 28733901.
- Wollert T, Hurley JH (April 2010). “Molecular mechanism of multivesicular body biogenesis by ESCRT complexes”. Nature. 464 (7290): 864–9. Bibcode:2010Natur.464..864W. doi:10.1038/nature08849. PMC 2851844. PMID 20305637.
- Baietti MF, Zhang Z, Mortier E, Melchior A, Degeest G, Geeraerts A, et al. (June 2012). “Syndecan-syntenin-ALIX regulates the biogenesis of exosomes”. Nature Cell Biology. 14 (7): 677–85. doi:10.1038/ncb2502. PMID 22660413. S2CID 30598897.
- Möbius W, Ohno-Iwashita Y, van Donselaar EG, Oorschot VM, Shimada Y, Fujimoto T, et al. (January 2002). “Immunoelectron microscopic localization of cholesterol using biotinylated and non-cytolytic perfringolysin O”. The Journal of Histochemistry and Cytochemistry. 50 (1): 43–55. doi:10.1177/002215540205000105. PMID 11748293.
- Mathieu M, Martin-Jaular L, Lavieu G, Théry C (January 2019). “Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication”. Nature Cell Biology. 21 (1): 9–17. doi:10.1038/s41556-018-0250-9. PMID 30602770. S2CID 57373483.
- Shirazi S, Huang CC, Kang M, Lu Y, Ravindran S, Cooper LF (March 2021). “The importance of cellular and exosomal miRNAs in mesenchymal stem cell osteoblastic differentiation”. Scientific Reports. 11 (1): 5953. Bibcode:2021NatSR..11.5953S. doi:10.1038/s41598-021-85306-2. PMC 7960990. PMID 33723364.
- Villarroya-Beltri C, Gutiérrez-Vázquez C, Sánchez-Cabo F, Pérez-Hernández D, Vázquez J, Martin-Cofreces N, et al. (December 2013). “Sumoylated hnRNPA2B1 controls the sorting of miRNAs into exosomes through binding to specific motifs”. Nature Communications. 4 (1): 2980. Bibcode:2013NatCo…4.2980V. doi:10.1038/ncomms3980. PMC 3905700. PMID 24356509.
- Villarroya-Beltri C, Baixauli F, Gutiérrez-Vázquez C, Sánchez-Madrid F, Mittelbrunn M (October 2014). “Sorting it out: regulation of exosome loading”. Seminars in Cancer Biology. 28: 3–13. doi:10.1016/j.semcancer.2014.04.009. PMC 4640178. PMID 24769058.
- Thind A, Wilson C (2016). “Exosomal miRNAs as cancer biomarkers and therapeutic targets”. Journal of Extracellular Vesicles. 5: 31292. doi:10.3402/jev.v5.31292. PMC 4954869. PMID 27440105.
- Liangsupree T, Multia E, Riekkola ML (January 2021). “Modern isolation and separation techniques for extracellular vesicles”. Journal of Chromatography A. 1636: 461773. doi:10.1016/j.chroma.2020.461773. PMID 33316564.
- Tauro BJ, Greening DW, Mathias RA, Ji H, Mathivanan S, Scott AM, et al. (February 2012). “Comparison of ultracentrifugation, density gradient separation, and immunoaffinity capture methods for isolating human colon cancer cell line LIM1863-derived exosomes”. Methods. 56 (2): 293–304. doi:10.1016/j.ymeth.2012.01.002. PMID 22285593.
- Van Deun J, Mestdagh P, Sormunen R, Cocquyt V, Vermaelen K, Vandesompele J, et al. (2014). “The impact of disparate isolation methods for extracellular vesicles on downstream RNA profiling”. Journal of Extracellular Vesicles. 3: 24858. doi:10.3402/jev.v3.24858. PMC 4169610. PMID 25317274.
- Böing AN, van der Pol E, Grootemaat AE, Coumans FA, Sturk A, Nieuwland R (2014). “Single-step isolation of extracellular vesicles by size-exclusion chromatography”. Journal of Extracellular Vesicles. 3: 23430. doi:10.3402/jev.v3.23430. PMC 4159761. PMID 25279113.
- Li X, Corbett AL, Taatizadeh E, Tasnim N, Little JP, Garnis C, et al. (March 2019). “Challenges and opportunities in exosome research-Perspectives from biology, engineering, and cancer therapy”. APL Bioengineering. 3 (1): 011503. doi:10.1063/1.5087122. PMC 6481742. PMID 31069333.
- Dhondt B, Lumen N, De Wever O, Hendrix A (September 2020). “Preparation of Multi-omics Grade Extracellular Vesicles by Density-Based Fractionation of Urine”. STAR Protocols. 1 (2): 100073. doi:10.1016/j.xpro.2020.100073. PMC 7580105. PMID 33111109.
- Dhondt B, Geeurickx E, Tulkens J, Van Deun J, Vergauwen G, Lippens L, et al. (11 March 2020). “Unravelling the proteomic landscape of extracellular vesicles in prostate cancer by density-based fractionation of urine”. Journal of Extracellular Vesicles. 9 (1): 1736935. doi:10.1080/20013078.2020.1736935. PMC 7144211. PMID 32284825.
- Geeurickx E, Tulkens J, Dhondt B, Van Deun J, Lippens L, Vergauwen G, et al. (July 2019). “The generation and use of recombinant extracellular vesicles as biological reference material”. Nature Communications. 10 (1): 3288. Bibcode:2019NatCo..10.3288G. doi:10.1038/s41467-019-11182-0. PMC 6650486. PMID 31337761.
- Multia E, Tear CJ, Palviainen M, Siljander P, Riekkola ML (December 2019). “Fast isolation of highly specific population of platelet-derived extracellular vesicles from blood plasma by affinity monolithic column, immobilized with anti-human CD61 antibody”. Analytica Chimica Acta. 1091: 160–168. Bibcode:2019AcAC.1091..160M. doi:10.1016/j.aca.2019.09.022. hdl:10138/321264. PMID 31679569. S2CID 203147714.
- Multia E, Liangsupree T, Jussila M, Ruiz-Jimenez J, Kemell M, Riekkola ML (October 2020). “Automated On-Line Isolation and Fractionation System for Nanosized Biomacromolecules from Human Plasma”. Analytical Chemistry. 92 (19): 13058–13065. doi:10.1021/acs.analchem.0c01986. PMC 7586295. PMID 32893620.
- Le MC, Fan HZ (2021-01-21). “Exosome isolation using nanostructures and microfluidic devices”. Biomedical Materials. 16 (2): 022005. doi:10.1088/1748-605X/abde70. ISSN 1748-6041. PMC 8082697. PMID 33477118.
- van der Pol E, Hoekstra AG, Sturk A, Otto C, van Leeuwen TG, Nieuwland R (December 2010). “Optical and non-optical methods for detection and characterization of microparticles and exosomes”. Journal of Thrombosis and Haemostasis. 8 (12): 2596–607. doi:10.1111/j.1538-7836.2010.04074.x. PMID 20880256. S2CID 37878753.
- Shao H, Chung J, Balaj L, Charest A, Bigner DD, Carter BS, et al. (December 2012). “Protein typing of circulating microvesicles allows real-time monitoring of glioblastoma therapy”. Nature Medicine. 18 (12): 1835–40. doi:10.1038/nm.2994. PMC 3518564. PMID 23142818.
- Im H, Shao H, Park YI, Peterson VM, Castro CM, Weissleder R, et al. (May 2014). “Label-free detection and molecular profiling of exosomes with a nano-plasmonic sensor”. Nature Biotechnology. 32 (5): 490–5. doi:10.1038/nbt.2886. PMC 4356947. PMID 24752081.
- Jeong S, Park J, Pathania D, Castro CM, Weissleder R, Lee H (February 2016). “Integrated Magneto-Electrochemical Sensor for Exosome Analysis”. ACS Nano. 10 (2): 1802–9. doi:10.1021/acsnano.5b07584. PMC 4802494. PMID 26808216.
- Shao H, Chung J, Lee K, Balaj L, Min C, Carter BS, et al. (May 2015). “Chip-based analysis of exosomal mRNA mediating drug resistance in glioblastoma”. Nature Communications. 6: 6999. Bibcode:2015NatCo…6.6999S. doi:10.1038/ncomms7999. PMC 4430127. PMID 25959588.
- van der Pol E, van Gemert MJ, Sturk A, Nieuwland R, van Leeuwen TG (May 2012). “Single vs. swarm detection of microparticles and exosomes by flow cytometry”. Journal of Thrombosis and Haemostasis. 10 (5): 919–30. doi:10.1111/j.1538-7836.2012.04683.x. PMID 22394434. S2CID 13818611.
- Yuana Y, Oosterkamp TH, Bahatyrova S, Ashcroft B, Garcia Rodriguez P, Bertina RM, et al. (February 2010). “Atomic force microscopy: a novel approach to the detection of nanosized blood microparticles”. Journal of Thrombosis and Haemostasis. 8 (2): 315–23. doi:10.1111/j.1538-7836.2009.03654.x. PMID 19840362. S2CID 5963526.
- Dragovic RA, Gardiner C, Brooks AS, Tannetta DS, Ferguson DJ, Hole P, et al. (December 2011). “Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis”. Nanomedicine. 7 (6): 780–8. doi:10.1016/j.nano.2011.04.003. PMC 3280380. PMID 21601655.
- Tatischeff I, Larquet E, Falcón-Pérez JM, Turpin PY, Kruglik SG (2012). “Fast characterisation of cell-derived extracellular vesicles by nanoparticles tracking analysis, cryo-electron microscopy, and Raman tweezers microspectroscopy”. Journal of Extracellular Vesicles. 1: 19179. doi:10.3402/jev.v1i0.19179. PMC 3760651. PMID 24009887.
- Pathan M, Keerthikumar S, Ang CS, Gangoda L, Quek CY, Williamson NA, et al. (August 2015). “FunRich: An open access standalone functional enrichment and interaction network analysis tool”. Proteomics. 15 (15): 2597–601. doi:10.1002/pmic.201400515. PMID 25921073. S2CID 28583044.
- Gaur P, Chaturvedi A (2016). “Mining SNPs in extracellular vesicular transcriptome of Trypanosoma cruzi: a step closer to early diagnosis of neglected Chagas disease”. PeerJ. 4: e2693. doi:10.7717/peerj.2693. PMC 5126619. PMID 27904804.
- Sjöqvist S, Ishikawa T, Shimura D, Kasai Y, Imafuku A, Bou-Ghannam S, et al. (20 January 2019). “Exosomes derived from clinical-grade oral mucosal epithelial cell sheets promote wound healing”. Journal of Extracellular Vesicles. 8 (1): 1565264. doi:10.1080/20013078.2019.1565264. PMC 6346716. PMID 30719240.
- Gupta A (2024). “Exosomes for the Management of Low Back Pain: A Review of Current Clinical Evidence”. Cureus. 16 (4): e57539. doi:10.7759/cureus.57539. PMC 11068073. PMID 38707134.
- Shao X, Zhang M, Chen Y, Sun S, Yang S, Li Q (June 2023). “Exosome-mediated delivery of superoxide dismutase for anti-aging studies in Caenorhabditis elegans”. International Journal of Pharmaceutics. 641: 123090. doi:10.1016/j.ijpharm.2023.123090. PMID 37268030. S2CID 259039593.
- Santos P, Almeida F (2021-07-14). “Exosome-Based Vaccines: History, Current State, and Clinical Trials”. Frontiers in Immunology. 12. doi:10.3389/fimmu.2021.711565. ISSN 1664-3224. PMC 8317489. PMID 34335627.
- Gebeyehu A, Kommineni N, Jr DG, Singh MS (2021). “Role of Exosomes for Delivery of Chemotherapeutic Drugs”. Critical Reviews in Therapeutic Drug Carrier Systems. 38 (5): 53–97. doi:10.1615/CritRevTherDrugCarrierSyst.2021036301. ISSN 0743-4863. PMC 8691065. PMID 34375513.
- Santos P, Almeida F (2021-07-14). “Exosome-Based Vaccines: History, Current State, and Clinical Trials”. Frontiers in Immunology. 12. doi:10.3389/fimmu.2021.711565. ISSN 1664-3224. PMC 8317489. PMID 34335627.
- “Public Safety Notification on Exosome Products”. Center for Biologics Evaluation and Research. U.S. Food and Drug Administration. 20 December 2019.
- Knoepfler P (2020-04-23). “Kimera Labs FDA letter cites exosomes for COVID-19, more issues”. The Niche. Retrieved 2021-03-02.
- “Limited Reporting of Adverse Events Tied to Regenerative Treatments Leaves Consumers Vulnerable”. pew.org. 31 July 2020. Retrieved 2021-03-02.
- “FDA Warning Letters Week of 4/20/2020: PMA, IDE, & Untitled Letter to Stem Cell Firm”. Redica. 2020-04-27. Retrieved 2021-03-02.
- Tiner S (22 July 2021). “Beyond stem cells, regenerative medicine finds exosomes”. Mayo Clinic News Network.
- Lee KW, Chan LK, Hung LC, Phoebe LK, Park Y, Yi KH (January 2024). “Clinical Applications of Exosomes: A Critical Review”. International Journal of Molecular Sciences. 25 (14): 7794. doi:10.3390/ijms25147794. ISSN 1422-0067. PMC 11277529. PMID 39063033.
- Santos P, Almeida F (2021-07-14). “Exosome-Based Vaccines: History, Current State, and Clinical Trials”. Frontiers in Immunology. 12. doi:10.3389/fimmu.2021.711565. ISSN 1664-3224. PMC 8317489. PMID 34335627.
- Mathivanan S, Simpson RJ (November 2009). “ExoCarta: A compendium of exosomal proteins and RNA”. Proteomics. 9 (21): 4997–5000. doi:10.1002/pmic.200900351. PMID 19810033. S2CID 22275212.